Wikisage is op 1 na de grootste internet-encyclopedie in het Nederlands. Iedereen kan de hier verzamelde kennis gratis gebruiken, zonder storende advertenties. De Koninklijke Bibliotheek van Nederland heeft Wikisage in 2018 aangemerkt als digitaal erfgoed.
- Wilt u meehelpen om Wikisage te laten groeien? Maak dan een account aan. U bent van harte welkom. Zie: Portaal:Gebruikers.
- Bent u blij met Wikisage, of wilt u juist meer? Dan stellen we een bescheiden donatie om de kosten te bestrijden zeer op prijs. Zie: Portaal:Donaties.
Reeline
| Reeline | ||
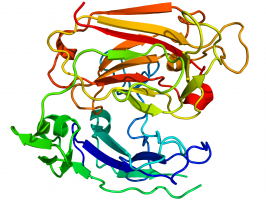
| ||
| Kristallografische structuur van Reeline. | ||
| Identificatoren | ||
| Symbol(en) | RELN RL | |
| Entrez | 5649 | |
| OMIM | 600514 | |
| RefSeq | NM_005045 | |
| UniProt | P78509 | |
| PDB | 2ddu | |
| Andere data | ||
| Locus | Chr. 7 q22 | |
Reeline (gevormd uit het Engelse werkwoord to reel, "waggelen, wankelen" en het achtervoegsel -ine) is een glycoproteïne in de extracellulaire matrix die in de 20e eeuw voor het eerst is beschreven. Deze stof wordt voornamelijk in de hersenen aangetroffen, maar komt ook voor in andere delen van het lichaam zoals de lever, de ruggengraat en het bloed[1]. Het gen dat voor reeline codeert is gelokaliseerd op het chromosoom 7q22 en staat bekend als het RELN-gen.
Reeline speelt vooral een belangrijke rol bij de ontwikkeling van het zenuwstelsel in embryo's. Het draagt namelijk in hoge mate bij aan het sturen van de neuronale migratie. Reeline stimuleert daarnaast de ontwikkeling van sommige dendrieten.[2][3] Het blijft ook een belangrijke rol spelen nadat de hersenen eenmaal zijn volgroeid; zo regelt reeline in deze fase bijvoorbeeld de synaptische plasticiteit[1][4]. Daarnaast regelt reeline de voortgezette migratie van nieuwe neuroblasten vanaf plekken waar tijdens de volwassenheid neurogenese plaatsvindt, zoals de subventriculaire zone en de subgranulaire zone.
Veel psychotische aandoeningen lijken rechtstreeks verband te houden met een afwijkende hoeveelheid reeline. Zo is er bij schizofrenie en bipolaire stoornis aanzienlijk minder dan normaal van dit eiwit in de hersenen aanwezig, hoewel over het precieze verband tussen deze twee zaken nog niet alles duidelijk is. Een te grote hoeveelheid reeline lijkt anderzijds een belangrijke rol te spelen bij aandoeningen als autisme, temporaalkwabepilepsie en de ziekte van Alzheimer. Wanneer er in het geheel geen reeline in het lichaam aanwezig is, is sprake van lissencefalie.
Geschiedenis
De ontwikkeling van het centraal zenuwstelsel op moleculair niveau wordt meestal bestudeerd aan de hand van mutaties bij muizen. In 1951 ontdekte Douglas Scott Falconer dat een bepaalde groep muizen een abnormaal wankelige manier van lopen vertoonde. Dit bleek het gevolg van een verstoorde ontwikkeling van het centrale zenuwstelsel[5]. Deze zogeheten reelermuis vertoonde de afwijking als gevolg van een mutatie van het RELN-gen, terwijl de afwijking tevens homozygoot bleek.
Muizen met een heterozygote mutatie van het RELN-gen vertonen weinig neuroanatomische afwijkingen ten opzichte van muizen met een homozygote mutatie van dit gen. Dierlijke modellen waarin genetische heterozygiteit samengaat met epigenese bleken echter toch bruikbaar als onderzoeksmodel bij de studie van de rol van downregulatie (een proces waarbij onder andere de hoeveelheid eiwitten vermindert) bij psychosen[6].
Nieuw histopathologisch onderzoek in de jaren '60 wees uit dat de kleine hersenen bij dit soort muizen veel kleiner waren dan gewoonlijk, terwijl op verschillende plekken in het brein de laminaire organisatie (de structuur van de hersenschorslagen) anders was. In de jaren '70 werd ook ontdekt dat in een deel van de neocortex van deze muizen de rangschikking van de diverse celtypen en weefsels anders was dan normaal. In grote lijnen was de volgorde van de cellagen omgekeerd, terwijl anderzijds de celdifferentiatie normaal leek te verlopen[7]. Op grond hiervan verschoof de aandacht naar de specifieke fysieke eigenschappen van deze zogeheten "reeler-mutatie".
Identificatie van het reelinegen
In 1994 werd door middel van mutagenese een nieuw allel verkregen, dat kon worden gekloond en vervolgens geïdentificeerd als het reelinegen. Japanse geleerden maakten bovendien met succes antistoffen tegen de reeler-mutaties aan. Voor reeline behoren deze immunoglobinen specifiek tot de monoklonale antistoffen, die met name bleken te reageren met de Cajal-Retziuscellen. Daarom kregen ze de naam CR-50 (Cajal-Retzius marker 50). Deze reacties verschaften meer duidelijkheid omtrent de rol van reeline tijdens de eerste fasen van de ontwikkeling van de hersenschors bij zoogdieren[1].
In 1998 werden ook de twee receptoren van reeline ontdekt: ApoER2 en de lipoproteïne-receptor VLDLR. Tegelijkertijd werd een eerste verband gelegd tussen deze receptoren en het ontstaan van de ziekte van Alzheimer. DAB1 kon als de belangrijkste regulator van de signaleringscascade van reeline worden aangewezen[8]. Nader onderzoek wees uit dat de hersenschorslagen van muizen met een dubbele knockout voor deze receptoren - die beide bleken te interageren met het gen DAB1 -, dezelfde gebreken vertoonden die ook bij reelermuizen waren aangetroffen. Zodoende was duidelijk geworden dat deze receptoren een belangrijke rol spelen bij de transmissie van het reelinesignaal[1]. Vervolgens werd ook nog aangetoond dat de afwijking in de corticale lagen bij muizen waarbij het gen DAB1 nagenoeg geheel afwezig was veel overeenkomst vertoonde met dezelfde afwijking bij reelermuizen.
De volgende stap was het leggen van allerlei verbanden tussen de functies van reeline en allerlei complexe aandoeningen, zoals autisme en de ziekte van Alzheimer. In 2008 was er vrij veel bekend over de structuur en functie van het eiwit[1].
Structuur
Reeline bestaat uit een reeks van 3461 aminozuren met een moleculaire massa van 388 kDa. Het proteïne is opgebouwd uit acht gelijke delen van 350-390 aminozuren. De structurele kenmerken maken enzymactiviteit op moleculair niveau mogelijk, zoals het verbreken van peptidebindingen met het aminozuur serine (serineprotease).[9].
Opbouw
De opbouw van reeline begint met een signalerende peptide die bestaat uit een keten van 27 aminozuren, in het schema hiernaast weergegeven met "S". Het volgende gebied (in het schema hiernaast in paars met "SP" weergegeven) vertoont veel overeenkomsten met het spondin 1-proteïne, een eiwit dat is betrokken bij eiwit-binding. De structuur van het derde gebied, hiernaast aangegeven in rood, met "H", is karakteristiek voor reeline. Hierna volgt een herhaling van 8 ketens met een lengte van 350 tot 390 aminozuren, de zogeheten reelin repeats (reelineherhalingen) (in geel aangegeven). In hun midden hebben deze herhaalde ketens een klein peptidehormoon (aangegeven met een blauwe lijn), het zogeheten EGF-domein, waardoor elke herhaalde keten in twee subketens (A en B) uiteenvalt. Ondanks deze onderbreking maken de subdomeinen rechtstreeks contact met elkaar, waardoor ze als geheel een compacte structuur vormen[10].
Het laatste gebied omvat een zeer kort en basisch C-terminaal gebied (CTR, in het schema weergegeven als "+") met een lengte van 32 aminozuren. Bij bijna alle onderzochte gewervelde dieren (behalve vissen) kwam alleen het laatste deel van de aminozuurketen (het CTR-gebied) voor 100% overeen, waarmee dit dus als het meest conservatieve deel van reeline kan worden beschouwd.
Codering
Bij muizen codeert het RELN-gen uit 65 exonen die gezamenlijk ongeveer 450.000 basenparen overspannen. In de structuur van het gen worden twee transcriptie-initiatiegebieden (starten de codering van een RNA-molecuul) en twee polyadenilatie-gebieden (voegen een staart toe aan een RNA-molecuul) onderscheiden.[11]. Een van de exonen in het gen - namelijk datgene dat codeert voor slechts twee aminozuren in de buurt van het einde van de peptidekete (C-Terminus) - ondergaat een alternatieve splitsing. Van dit exon is de precieze functie nog onbekend.
Aanmaak (expressie)
Reelin-exprimerende cellen worden voor en kort na de geboorte vooral aangetroffen in de marginale zone van de hersenschors en de tijdelijk aanwezige subpiale granulaire laag. Bij mensen is dit het meest uitgesproken[12] Het eiwit wordt in de prenatale fase afgescheiden door de in de cortex en de hippocampus aanwezige Cajal-, Retzius- en Cajal-Retziuscellen.[1].
Bij alle tot nu toe bestudeerde gewervelde dieren is in de telencephala reeline aangetroffen. Het expressiepatroon varieert daarentegen bij sommige diersoorten; zo wordt het eiwit bijvoorbeeld bij zebravissen - die geen Cajal-Retziuscellen hebben - door zenuwcellen in het hele dorsale gedeelte van het pallium geëxprimeerd[13]. Ook in de hersenschors van schubreptielen is de verdeling van reeline-exprimerende cellen anders[14].
Cajal-Retziuscellen scheiden reeline af in combinatie met het zogeheten HAR1(Human accelerated regions)-gen, dat bij de mens ten opzichte van de chimpansee een zeer sterke evolutionaire verandering heeft doorlopen. Dit gen wordt bij embryo's van zoogdieren tussen de 7e en de 19e week van de zwangerschap afgescheiden in de zich ontwikkelde neocortex. Samen met reeline vormt het hiervan de typisch zeslagige structuur[15].
In de cortex en hippocampus van volwassen ratten vindt expressie van reeline hoofdzakelijk plaats in zenuwcellen waar synthese van gamma-aminoboterzuur (GABA) plaatsvindt en door de weinige overgebleven Cajal-Retziuscellen[16].
Nader onderzoek wees overigens uit dat het CTR-gebied niet voor de expressie van reeline verantwoordelijk is, wat eerder werd gedacht vanwege het feit dat in de genen van reelermuizen die een deel van de 8e herhaalde aminozurenreeks en de hele CTR misten het eiwit niet werd afgescheiden. In plaats daarvan draagt de C-terminaal vermoedelijk bij aan de downstreamsignalering, doordat het zich aan een of meerdere coreceptormoleculen op het celmembraan bindt[17].
SAM, een methylgroepdonor en noodzakelijk voor de activiteit van het enzym DNMT, zou ook de epigenetische sturing van genexpressie verder kunnen beïnvloeden.
Andere factoren die de expressie beïnvloeden
De expressie van reeline hangt behalve van de Cajal-Retziuscellen nog af van een aantal andere factoren. Het eiwit CINAP vormt dankzij zijn interactie met CASK een complex met de transcriptiefactor TBR-1. Dit complex stuurt op zijn beurt de expressie aan van genen die door TBR-1 en CASK worden gecontroleerd, waaronder het RELN-gen.[18] Een post-mortem studie wees verder uit dat in de neocortex van personen die de puberteit al hadden doorlopen de methylatie van het RELN-gen veel hoger was dan bij personen die nog niet in de puberteit waren aanbeland.
De transcriptiefactor TBR 1 reguleert het eiwit samen met enkele andere genen die T-elementen bevatten.[19] Bij jonge ratten bleek de moederlijke zorg van invloed te zijn op de dendritische structuur en functie van laag 2/3 van piramideneuronen van de somatosensorische cortex en op het transcriptoom in de hippocampus, en bijgevolg ook op de expressie van allerlei genen in deze gebieden, waaronder het reelinegen (RELN-gen). Het feit dat dit effect zowel kan worden gestimuleerd als afgeremd, suggereert dat het ook nog omkeerbaar is nadat de ratten eenmaal volwassen zijn geworden.[20][21]
Volgens nog meer onderzoek neemt als gevolg van herhaaldelijke blootstelling aan corticosteron het aantal reeline-positieve cellen en daarmee de expressie van reeline in de hippocampus van ratten af.[22]
Voorkomen
Omdat het eiwit reeline voornamelijk betrokken is bij de prenatale ontwikkeling van het zenuwstelsel, is de hoeveelheid ervan het grootst in de embryonale fase van het organisme.
Bij de ontwikkeling van de kleine hersenen wordt reeline het eerst aangetroffen in de uitwendige granulaire laag en in delen van het tectum, de hypothalamus en de ruggengraat, waarna migratie naar de inwendige lagen plaatsvindt. Behalve in de hersenen wordt reeline ook nog aangetroffen in het bloed (met name bij volwassen organismen), de lever, een deel van de pars intermedia in de hypofyse en de bijnieren. De concentratie reeline in de lever is verhoogd bij een leverbeschadiging, en keert terug op normaal niveau als de lever is genezen. Ook in de ogen wordt reeline afgescheiden, namelijk in het netvlies en het hoornvlies. Uit proeven met muizen blijkt dat de meeste expressie van reeline plaatsvindt tijdens de ontwikkeling van het netvlies. Net als in de lever neemt de expressie van reeline ook toe na verwondingen. Tenslotte wordt het eiwit afgescheiden door de odontoblasten aan de randen van het tandpulpa. Zowel gedurende het hele proces van tandontwikkeling als in volwassen tanden wordt op deze plekken reeline aangetroffen[1].
Onderzoek heeft uitgewezen dat reeline niet aanwezig is in de synaptische blaasjes, maar door middel van exocytose wordt uitgescheiden door de blaasjes van het Golgi-apparaat. De snelheid waarmee het eiwit vrijkomt is niet afhankelijk van depolarisatie, maar wordt uitsluitend bepaald door de snelheid waarmee de synthese plaatsvindt. Iets soortgelijks gaat op voor de expressie van andere eiwitten in de extracellulaire matrix.
Mechanisme
Reeline is een ligand die hoofdzakelijk bindt aan de twee lipoproteïne-receptoren VLDLR en ApoER2.[23] ApoER2 (Apolipoprotein E Receptor 2) is een molecuul dat zich aan het oppervlak van cellen bevindt en daar onder invloed van de reeline transductie van genen tussen cellen initieert.[24] Dankzij deze bindingen worden clusters gevormd, die op hun beurt vermoedelijk een cruciale rol spelen bij het verloop van de signaaltransductie. De intracellulaire adaptor DAB1 kan hierdoor op zijn beurt gaan dimeriseren of oligomeriseren. Aangetoond is dat soortgelijke clusters zelfs bij afwezigheid van reeline een dergelijke signaalketen kunnen activeren.[25]
De rollen die de twee hoofdreceptoren van reeline in de neuronale migratie spelen lijken niet helemaal hetzelfde. Zo lijkt VLDLR hoofdzakelijk het stopsignaal voor de migratie door te geven, terwijl ApoER2 verantwoordelijk is voor de migratie van neocorticale zenuwcellen.[26]
Interactie van het gen van ApoER2 met NMDA-receptoren vormt de basis voor vergroting van de langetermijnpotentiatie dankzij reeline. Deze interactie treedt op wanneer ApoER2 een intracellulair domein bevat dat wordt gecodeerd door het exon 19 en het gen alternatief wordt gesplitst.[27]
Volgens een studie exprimeert de radiale glia dezelfde hoeveelheden ApoER2 af als de zenuwcellen, maar tienmaal minder VLDLR[28]. Volgens een andere studie spelen de op de neuroglia aanwezige bèta-1-integrine-receptoren (CD29) een zeer belangrijke rol bij de vorming van de afzonderlijke cellagen in de hersenschors en een minder belangrijke rol bij de migratie van neuroblasten.[29]
Fosforylering van DAB1
Bewezen is dat reelinemoleculen een complex geheel van eiwitten vormen, het zogeheten disulfinegebonden homodimeer. Wanneer deze homodimeer niet wordt gevormd, is een goede tyrosine-fosforylering van DAB1 welke nodig is voor transductie van het reelinesignaal in vitro gedoemd te mislukken.[30][31]
De intracellulaire adaptor DAB1 gaat met VLDLR en ApoER2 een verbinding volgens het NPxY-patroon aan. DAB1 speelt daarnaast een rol bij de transmissie van reelinesignalen via deze lipoproteïnereceptoren. Vervolgens vindt fosforylering door de tyrosine-kinasen Src en FYN plaats, wat het actine-cytoskelet vermoedelijk stimuleert om van vorm te veranderen.[32][33] Het aandeel integrinereceptoren aan het oppervlak van cellen verandert hierdoor, en hierdoor verandert weer de celadhesie.
Fosforylering van DAB1 leidt tot posttranslationele modificatie (ubiquitinatie) en vervolgens afbreking van deze stof, hetgeen de verhoogde hoeveelheid DAB1 in combinatie met een tekort aan reeline kan verklaren.[34] Deze tegenkoppeling lijkt van groot belang voor een goed verloop van de corticale laminatie, aangezien de migratie van zenuwcellen hierdoor in banen wordt geleid.[35] Dankzij twee antilichaampjes veroorzaken VLDLR en ApoER2 fosforylering van DAB1, maar schijnbaar zonder dat DAB1 vervolgens wordt afgebroken en zonder dat het reeler-fenotype wordt gered. Dit is mogelijk en teken dat een deel van het signaal onafhankelijk van DAB1 wordt doorgestuurd.[36]
Demethylatie
Volgens een studie bij ratten neemt als gevolg van demethylatie van het RELN-gen de expressie van reeline in de hippocampus sterk toe wanneer er iets in het geheugen moet worden opgeslagen, bijvoorbeeld bij angst.[37]
Splitsing
Reeline kan op twee plekken worden gesplitst: na het tweede en het zesde domein, tussen de herhalingen 2/3 en 6/7. Hierdoor ontstaan 3 fragmenten. Deze splitsing leidt echter niet tot een verminderde eiwitactiviteit, omdat de delen die ontstaan uit de centrale fragmenten (de herhaalde aminozuurreeksen 3-6) zich binden aan de lipoproteïne-receptoren, waar ze fosforylatie van het DAB1-gen in de zich ontwikkelende zenuwcellen op gang brengen en zo de rol van reeline in de zich ontwikkelende hersenschors imiteren.[38]
Andere interacties
Van het enzym cycline-afhankelijke kinase 5, een belangrijke regelaar van de migratie en positionering van zenuwcellen, is bekend dat het verantwoordelijk is voor fosforylering van DAB1 en andere doelwitten van reelinesignalering zoals het tau-eiwit[39][40] Dit eiwit wordt mogelijk geactiveerd dankzij door reeline veroorzaakte deactivatie van GSK3B en NUDEL in verbinding met het gen PAFAH1B1.[41][42]
Anderzijds kan reeline, doordat het een serineprotease is, bepaalde peptideverbindingen verbreken waardoor andere eiwitten bijeen worden gehouden. Hierdoor kunnen met name het verloop van de neuronale migratie en de adhesie van cellen aan fibronectine negatief worden beïnvloed.[43]
Een eiwit met de naam PAFAH1B1, dat een belangrijke rol speelt bij lissencefalie, vertoont daarnaast interactie met (d.w.z. bindt zich aan) het intracellulaire segment van de receptor VLDLR. Het "communiceert" hierdoor ook met reeline, doordat het reageert op het geactiveerde reeline-reactiepad.[44]
Aangetoond is dat het integrine alfa 3 bèta 1 zich tijdens de vorming van de hersenschors bindt aan de N-terminus van reeline, een gebied dat wordt onderscheiden van het deel dat een binding met de receptoren VLDLR en ApoER2 aangaat, waardoor de neuronale migratie wordt afgeremd.[45] Eerder werd aangenomen dat reeline zich bond aan de cadherine-gebonden neuronale receptor CNR1, maar dit idee is inmiddels weerlegd.[36][46] De reelinereceptoren zijn zowel op zenuwcellen als op de gliacellen aanwezig.
Functies
De precieze functie van reeline wordt vooral bepaald door het tijdstip waarop de expressie ervan plaatsheeft en de plaats in het lichaam waar het een rol speelt. De manier waarop het centrale of volledige deel van reeline door embryonale zenuwcellen wordt verwerkt is mogelijk in hoge mate bepalend voor een goed verloop van de signalering en de corticogenese.[47]. Het is daarnaast intensief betrokken bij diverse andere processen waar nog onderzoek naar wordt verricht.
Signalering
Onderzoek heeft aangetoond dat reeline de Notch1-signaleringscascade op een bepaalde manier activeert door de expressie van FABP7 op gang te brengen. Ook lijkt het de vorming van het radiaire gliale fenotype in progenitorcellen te stimuleren.[48]
Volgens ander onderzoek is een goed verloop van de corticogenese afhankelijk van de manier waarop reeline in de embryonale fase door de zenuwcellen wordt verwerkt.[49] Vermoed wordt namelijk dat deze zenuwcellen bepaalde - tot nu toe ongeïdentificeerde - metalloproteinasen afscheiden, die een deel van het eiwit "bevrijden". Ook andere nog onbekende proteolytische mechanismen spelen in dit proces mogelijk een rol.[50] De grootste delen reeline blijven vermoedelijk plakken aan vezels van de hogergelegen extracellulaire matrix en centrale fragmenten, aangezien deze nadat de reeline eenmaal is afgebroken kunnen doordringen tot de lagere gedeelten.[49] Wanneer de neuroblasten eenmaal op het hoogste niveau zijn aangekomen, stoppen ze mogelijk met migreren. Dit is het gevolg van de verhoogde gecombineerde expressie van alle soorten reeline of van het typische gedrag van de grootste reeline-moleculen en bijbehorende homodimeren.[1]
Als leden van de superfamilie van lipoproteïne-receptoren hebben zowel VLDLR als ApoER2 een insluitingsgebied (structureel motief) met de naam NPxY. Na de binding aan de receptoren wordt de reeline ingesloten door middel van endocytose. Volgens een studie wordt het N-terminale fragment van reeline hierna opnieuw afgescheiden,[51] terwijl dit fragment volgens een andere studie helpt bij het na de geboorte voorkomen van vergroeiing van de apicale dendrieten van de piramidale neuronen van de corticale lagen I en II.[52] Volgens nog meer onderzoek leidt reeline-signalering tot fosforylatie van het met actine interagerende eiwit CFL1, en worden hierdoor het actine cytoskelet gestabiliseerd en de migratie van neuroblasten afgeremd.[53][54]
Ontwikkeling en herstel van organen en weefsels
Reeline wordt afgescheiden door een aantal weefsels en organen in het zich ontwikkelende organisme, en de expressie neemt sterk af nadat het orgaan volledig is gevormd. De exacte rol van reeline in de zich nog ontwikkelende organen en weefsels is nog grotendeels onbekend, omdat in de betreffende organen van de proefmuizen geen grote afwijkingen zijn gevonden.
Bij volwassen dieren en mensen is de expressie van reeline alleen nog tijdelijk hoger dan normaal bij verwondingen. Na herstel keert de expressie terug op het normale niveau.[55] Over de precieze rol van deze upregulatie van reeline na een verwonding is nog weinig bekend.[55][56]
Zenuwstelsels
De rol die reeline speelt bij de groei en ontwikkeling van het centraal zenuwstelsel is belangrijker en hier is ook meer over bekend. Reeline stimuleert de differentiatie van progenitorcellen naar radiaire gliacellen. Ook beïnvloedt het de vezeloriëntatie hiervan. Hierdoor worden migrerende neuroblasten aangestuurd.[28] De locatie van de reeline-exprimerende cellaag is hierbij van groot belang, omdat vezels zich oriënteren in de richting van de hoogste concentratie hiervan.[57] Dankzij deze oriëntatie worden onder meer de laagspecifieke verbindingen tussen de hippocampus en de entorinale schors door reeline geregeld.[58]
Ook in volwassen zenuwstelsels blijft reeline een belangrijke rol spelen in de twee meest actieve gebieden waar de neurogenese plaatsvindt: de subventriculaire zone en de gyrus dentatus. Bij sommige diersoorten migreren de neuroblasten eerst in ketens vanuit de subventriculaire zone als onderdeel van de rostrale migratoire stroom (RMS) naar de bulbus olfactorius, waar ze vervolgens door de reeline worden gedissocieerd om uiteindelijk als individuele cellen verder te gaan. De migratie van deze individuele cellen verandert daarbij van tangentieel in radiair, terwijl de cellen de radiaire gliavezels gebruiken als "gids".
Volgens onderzoek functioneren de receptoren ApoER2 en VLDLR en hun intracellulaire adapter DAB1 in de postnatale neuronale migratie onafhankelijk van reeline en onder invloed van het eiwit Tsp-1.[59][60]
In de volgroeide gyrus dentatus fungeert reeline als sturingsmechanisme voor nieuwe neuronen die vanuit de subgranulaire zone in de laag granulecellen belanden.[61] In de volwassen hersenen draagt het eiwit voornamelijk bij aan het reguleren van de hoeveelheid afgescheiden corticale piramidecellen, de vertakking van dendrieten en de langetermijnpotentiatie.[4]
Volgens tot nu toe onbewezen stellingen fungeert de reeline in het tandpulpa bovendien als een soort schakel tussen de odontoblasten en de zenuwuiteinden bij het doorgeven van pijnsignalen.[62]
Volgense enkele Franse wetenschappers draagt reeline bovendien bij aan de configuratie van NMDA-receptoren, doordat het eiwit de mobiliteit van receptoren die GRIN2B bevatten verhoogt.[63][64] Dit proces zou er op zijn beurt aan bijdragen dat de hersenen zich blijven ontwikkelen na de geboorte.[65]
Het lijkt erop dat activatie via reeline van de groei van dendrieten via kinasen van de Src-familie verloopt, en afhangt van de expressie van eiwitten die tot de CRK-familie behoren.[66] Dit is in overeenstemming met de interactie van Crk en CrkL met tyrosine-gefosforyleerde DAB-1.[67] Ook de overlappende functies van de genen Crk en CrkL bij neuronale migratie door middel van reeline is onderzocht aan de hand van op muizen toegepaste Cre/loxP-systemen waarin de betreffende genen ontbraken.[68]
Corticogenese
De ontwikkeling van de hersenschors bij zoogdieren is een ander proces waarin reeline een zeer belangrijke rol speelt, met name in de allereerste fase waarin de zogeheten "preplaat" wordt opgesplitst in een oppervlakkige marginale zone en een tijdelijke subplaat. Tussen deze twee lagen bewegen zich volgens het "inside out"-principe de neuronale lagen[69].
Het migreren van pas gevormde zenuwcellen naar de bovenliggende lagen is kenmerkend voor de hersenen van zoogdieren, in de zich ontwikkelende hersenschors van reptielen migreren de zenuwcellen net in de omgekeerde richting.[70] Reeline blijkt een sturende rol te hebben in de tangentiële migratie van zowel de interneuronen naar de corticale plaat als die van de pioniersneuronen naar de marginale zone.[71] Een reelinetekort heeft bij zoogdieren dan ook tot gevolg dat ook de uiteindelijke volgorde van de hersenschorslagen min of meer wordt omgedraaid.
Over de precieze manier waarop reeline de tangentiële migratie en daarmee de uiteindelijke volgorde van de hersenschorslagen beïnvloedt bestaat echter nog geen overeenstemming. De oudste hypothese is dat het eiwit een stopsignaal afgeeft aan de migrerende cellen. Dit lijkt te worden bevestigd door het feit dat reeline dissociatie in gang kan zetten, waarbij de migrerende zenuwcellen van hun "leidende" gliacellen worden losgemaakt om als individuele cellen verder te gaan. Daarnaast speelt het eiwit een rol bij de handhaving van de compacte laag granulecellen in de hippocampus. Verder is het zo dat migrerende neuroblasten reelinerijke gebieden mijden, wat erop wijst dat reeline een celafstotende stof is.[72][73]
Het feit dat de corticogenese bij sommige muizen normaal verloopt ondanks een verkeerde rangschikking van de reeline-exprimerende hersenschorslagen[74] en het gebrek aan bewijs voor het idee dat reeline de groeikegels en sturende zenuwuiteinden beïnvloedt laat ook ruimte voor andere mogelijkheden. Zo zou reeline de cellen bijvoorbeeld extra gevoelig kunnen maken voor bepaalde grote hoeveelheden signaleringscascades, doordat het eiwit tijdens de postnatale neurogenese de migrerende voorlopers van de zenuwcellen beïnvloedt dankzij een signaal dat deze cellen van de gliacellen scheidt (zie ook transductie).[72][75] Daarnaast is het goed mogelijk dat reeline een belangrijke rol speelt bij op hun plaats terechtkomen van autonome zenuwcellen in de ruggengraat.[76] Volgens één studie beïnvloeden de plaats en mate van de reeline-expressie de beweging van sympathische preganglionaire neuronen.[77]
Rol in de evolutie
De vermeerderde expressie van het reelinegen en DAB1 in de marginale zone in combinatie met de interactie van reeline met DAB1 heeft vermoedelijk een zeer belangrijke rol gespeeld bij de ontwikkeling van de meerlagige hersenschors bij moderne zoogdieren, die bij amniota nog uit slechts één enkele laag bestond.[78] Nader onderzoek heeft uitgewezen dat de expressie van reeline sterk toeneemt bij complexere cortexen. Doordat in het menselijk brein de Cajal-Retziuscellen een zeer uitgebreid netwerk van axonen vormen, is de expressie van reeline hier maximaal.[79] Dit is mogelijk het gevolg van de vorming van een aparte corticale laag die voor deze expressie verantwoordelijk is.[80]
Over het precieze verband tussen deze complexe gelaagdheid en signaalpathways bestaat nog geen overeenstemming.[75][81] Een andere mogelijkheid die is geopperd is de ontwikkeling in de prenatale fase van reelineproducerende cellen uit cellen die voorheen reelinenegatief waren.[12]
In 2007 werd bovendien ontdekt dat een bepaalde variant van het gen DAB1 alleen bij de Chinese bevolking voorkomt. Dit wijst erop dat het reactiepad van reeline nog steeds muteert.[82][83]
Mogelijke rol bij aandoeningen
Lissencefalie
Verstoringen van het reelinegen worden verondersteld ten grondslag te liggen aan een zeldzame vorm van lissencefalie met cerebellaire hypoplasie, die bekend staat als het Norman-Roberts syndroom.[1] Als gevolg van de mutaties wordt het splicingproces van cDNA verstoord, hetgeen leidt tot te lage of ondetecteerbare reelinehoeveelheden. De patiënten vertonen hypotonie, ataxie, achterstand in zowel de geestelijke als de lichamelijke ontwikkeling (bijvoorbeeld niet zelfstandig kunnen zitten en weinig of geen taalverwerving). Andere symptomen van deze aandoening zijn epileptische insulten en lymfoedemen. In 2007 werd vastgesteld dat een nieuwe chromosomale translocatie verantwoordelijk was voor de betreffende ziektebeelden. Aangenomen wordt dat mutaties die de hoeveelheid reeline bij mensen beïnvloeden vaak het gevolg zijn van huwelijk onder bloedverwanten.[84]
Schizofrenie
Volgens onderzoek is de concentratie s-adenosyl-methionine (SAM) in de prefrontale cortex van schizofreniepatiënten en patiënten met een bipolaire stoornis tweemaal zo hoog is als bij mensen zonder psychische afwijking het geval is. Dit gaat gepaard met een verhoogde expressie van het enzym DNA methyltransferase-1 DNA mRNA.[85]
Uit post-mortem onderzoek bleek, dat in de hersenen van schizofreniepatiënten een verminderde mate van expressie van reeline en het bijbehorende Messenger RNA plaatsvond. In sommige gebieden van de hersenen kan deze vermindering oplopen tot 50%, en gaat ze tevens gepaard met een verminderde expressie van het enzym GAD-67, dat een katalysator is voor de omzetting van glutaminezuur in gamma-aminoboterzuur. Volgens een studie veranderen bij schizofrenie de hoeveelheden reeline en isovormen in het bloed, wat een belangrijke oorzaak van stemmingsstoornissen zou kunnen zijn.[1]
Verhoogde DNMT1-expressie
Als mogelijke oorzaak van de verminderde hoeveelheden reeline-mRNA en reeline bij schizofrenie is epigenetische hypermethylatie van de reelinegenpromotor genoemd.[86] Deze bevindingen komen overeen met observaties uit de jaren '60, waaruit bleek dat het toedienen van methionine bij schizofreniepatiënten in 60 tot 70 % van de gevallen leidde tot een ernstige verergering van de symptomen van deze aandoening.[87][88][89][90] Uit autopsie bleek tevens dat in de corticale laag V van schizofreniepatiënten zowel de hoeveelheid DNMT1 als de hoeveelheid reeline normaal zijn ten opzichte van gewone patiënten, terwijl in hun corticale laag I de hoeveelheid DNMT1 driemaal zo hoog was. Dit laatste leidt vermoedelijk tot een verminderde expressie van reeline bij schizofrenie.[91]
Een te hoge expressie van DNMT1 lijkt vooral plaats te vinden in de reeline-afscheidende GABA-ergische zenuwcellen en niet in hun glutamergische buren.[92] Methylatieremmers en remmers van histone deacetylase (zoals valproïnezuur) vergroten de hoeveelheid reeline-mRNA.[93][94][95]
Behandeling
Behandeling met L-methionine bij muizen leidde tot een downregulatie van de fenotypische expressie van reeline.[96] DNMT-1 remmers bij dieren lijken zowel de expressie van reeline als die van GAD67 te bevorderen.[97]
Ook DNMT-remmers en HDAC-remmers lijken de aanmaak van deze stoffen te bevorderen.[98]
Dit alles lijkt de epigenetische hypothese met betrekking tot de rol van reeline in schizofrenie te bevestigen.[99] Hier komt bij dat de Cajal-Retzius cellen van muizen die al voor hun geboorte met een influenza besmet raakten of waarvan het afweersysteem kunstmatig werd beïnvloed bij de geboorte veel minder reeline afscheiden dan gewoonlijk. De expressie van calretinine en NOS1 lag bij deze muizen daarentegen op normaal niveau. Bij schizofreniepatiënten die een prenatale infectie hebben opgelopen zijn soortgelijke verschijnselen vastgesteld.[100][101]
Anderzijds is de hypothese van hypermethylatie van reeline door twee andere studies niet bevestigd.[102][103] Onderzoek bij dieren heeft verder uitgewezen dat ook psychofarmaca de expressie van reeline kunnen beïnvloeden.
Het chromosoomgebied 7q22 is de locatie van het reelinegen. Dit gebied wordt daarnaast verondersteld een rol te spelen bij schizofrenie.[104] Het gen zelf is met schizofrenie in verband gebracht in een uitgebreide studie, waarin bleek dat het polymorfisme rs7341475 het risico op schizofrenie wel bij vrouwen maar niet bij mannen verhoogde. Vrouwen met dit enkel-nucleotide polymorfisme lopen volgens deze studie 1,4x zoveel kans op schizofrenie.[105] Bij families waarin schizofrenie voorkomt zijn variaties in het RELN-allel in verband gebracht met het werkgeheugen.[104][106]
Dendritogenese
Ook de manier waarop reeline de dendritogenese positief beïnvloedt doordat het de hippocampale zenuwcellen stimuleert is onderzocht.[2][66] Een verminderde hoeveelheid reeline kan voor een verstoring in de ontwikkeling van dendrieten die mogelijk weer ten grondslag ligt aan schizofrenie zorgen. Bij schizofreniepatiënten is daarnaast een verminderde dichtheid van dendritische spines in verschillende corticale gebieden geconstateerd.[107][108] Op grond van dit en meer onderzoek is de mogelijkheid geopperd dat tekorten aan spine en neuropil in de neocortex van psychiatrische patiënten gedeeltelijk verband zouden kunnen houden met een gedownreguleerde expressie van zowel reeline als van mRNA.[109][110]
VLDL-receptoren
Een andere studie toont aan dat schizofreniepatiënten in de perifere lymfocyten een verminderde hoeveelheid VLDL-receptoren (VLDLR) hebben.[111] Na een half jaar durende behandeling met antipsychotica steeg de expressie. Perifere VLDLR-niveaus kunnen dus in de toekomst mogelijk als een betrouwbare biomarker voor schizofrenie dienen.[111]
Risicogenen
Ook de interactie van reeline met bepaalde risicogenen speelt mogelijk een rol bij schizofrenie en andere psychische aandoeningen. Een voorbeeld is de neuronale transcriptiefactor NPAS3, waarvan de verstoring mogelijk de basis vormt voor schizofrenie en achterstanden in het leerproces.[112] Knockout-muizen die dit of het gelijksoortige eiwit NPAS1 missen hebben daarnaast aanzienlijk minder reeline, maar het precieze verband tussen deze factoren is nog onbekend.[113] Een ander voorbeeld is het met schizofrenie verband houdende gen methylenetetrahydrofolate reductase. Muizen (en vermoedelijk mensen) met een tekort aan dit gen hebben een verminderde hoeveelheid reeline in het cerebellum.[114]
In ditzelfde verband moet worden opgemerkt dat de gencodering voor de subeenheid NR2B, die als een van de meest risicovolle kandidaatgenen geldt, mogelijk beïnvloed wordt door reeline.[64][115] Een ander gemeenschappelijk kenmerk van NR2B en RELN is dat ze beide kunnen worden gereguleerd door de transcriptiefactor TBR1.[116]
Haploinsufficiëntie
De heterozygote reelermuis is haploinsufficiënt voor het RELN-gen en vertoont bepaalde afwijkingen die ook voorkomen bij schizofrenie en bipolaire stoornissen, zoals downregulatie van reeline-mRNA en een verminderde hoeveelheid dendritische spinen in de zenuwcellen van de hersenschors en hippocampus.[117] Het fenotype van deze muis wordt echter niet beschouwd als voorbeeld van een genetisch standaardmodel voor de studie van schizofrenie.[118]
Bipolaire stoornis
Post-mortem onderzoek van menselijke hersenen heeft aangetoond dat een verminderde expressie van het reelinegen in combinatie met upregulatie van het enzym DNMT1 enerzijds wel kenmerkend is voor bipolaire stoornissen in combinatie met psychose, maar anderzijds niet kenmerkend voor langetermijndepressies. Volgens een onderzoek uit 2006 is bij mensen met een bipolaire stoornis de hoeveelheid DNMT1 en bijgevolg ook de hoeveelheid reeline en GAD67 in de basale ganglia op normaal niveau, terwijl in de prefrontale cortex sprake is van dezelfde afwijkingen als bij schizofreniepatiënten.
In 2009 kwamen aanwijzingen dat veranderingen van het RELN-gen (SNP rs362719) specifiek verband houden met bipolaire stoornis bij vrouwen. Voor meer zekerheid hierover is nieuwe replicatie van DNA vereist.[119]
Depressie
Een verminderde hippocampale plasticiteit werkt depressies in de hand en kan het gevolg zijn van een verminderde reeline-expressie. Dit zou tevens verband kunnen houden met de veronderstelde rol van corticosteroïden bij depressies.[120]
Autisme
Autisme is een neuronale ontwikkelingsstoornis die vermoedelijk wordt veroorzaakt door mutaties op verschillende plaatsen die hun oorsprong vinden in omgevingsfactoren. Over de rol van reeline bij autisme is nog weinig duidelijk. Het reelinegen is gesitueerd in chromosoomlocus 7q22, een gebied dat in verband wordt gebracht met vatbaarheid voor autisme. In de post-mortem onderzochte hersenen van mensen met autisme zijn verminderde hoeveelheden reeline aangetroffen. Onderzoek naar het veronderstelde verband tussen reeline en autisme heeft echter tot nu toe alleen tegenstrijdige resultaten opgeleverd, hoewel de studie van afwijkingen in de hersengroei en neuro-ontwikkeling en de functie en structuur van synapsen en dendrieten bij transgenetische muizen wel in de richting van een bestaand verband wijzen.[121]
Temporaalkwabepilepsie
Een verstoring van de neuronale migratie als gevolg van een verminderde expressie van reeline in het weefsel van de hippocampus lijkt bij een deel van de patiënten rechtstreeks verband te houden met de migratie van korrelcellen, en daarmee met epilepsie aan de temporale kwab. Verhoogde hypermethylatie van de reeline-promotor speelt ook een rol.[122][123][124]
Uit ander onderzoek blijkt dat reeline bij ratten en andere knaagdieren de migratie van progenitorcellen van granulecellen (DGC) aanstuurt en zo de integratie van deze cellen in de gyrus dentatus regelt. Dit gebeurt zowel bij ongeboren als bij volwassen exemplaren. Dissociatie van de migrerende neuroblasten zonder reeline verloopt niet goed. DGC-cellen spelen op hun beurt een grote rol bij epileptische aanvallen.[125]
In een door middel van kainzuur opgewekt experimenteel epilepsiemodel bij muizen heeft exogene reeline de voor temporaalkwabepilepsie typische verspreiding van DGC-cellen als gevolg van een verstoorde migratie voorkomen.[126]
Ziekte van Alzheimer
Volgens een studie gaat de ziekte van Alzheimer gepaard met een veranderd patroon van zowel de reeline-expressie als de glycosylatie. De in de cortex van onderzochte Alzheimer-patiënten aangetroffen hoeveelheid reeline was 40% hoger dan gebruikelijk, terwijl de hoeveelheid eiwit in het cerebellum hetzelfde was als bij mensen zonder Alzheimer.[127] Dit komt overeen met een eerdere studie waarin aan de hand van AD-soortgelijke transgenetische muismodellen de aanwezigheid van reeline in amyloïde-plaques aannemelijk werd gemaakt.[128] Het aantal Cajal-Retzius cellen in de eerste corticale laag dat reeline aanmaakt is daarentegen abnormaal laag bij Alzheimer-patiënten, waardoor de synaptogenese negatief wordt beïnvloed.[129][130]
Een uitgebreide studie uit 2008 toont bovendien aan dat veranderingen in het RELN-gen bij vrouwen verband houden met een toegenomen kans op Alzheimer.[131] Reeline interageert met het amyloïde precursor eiwit, wat de ontwikkeling van neurieten stimuleert<.ref>(en) Hoe HS, Lee KJ, Carney RS, Lee J, Markova A, Lee JY, Howell BW, Hyman BT, Pak DT, Bu G, Rebeck GW (June 2009). "Interaction of reelin with amyloid precursor protein promotes neurite outgrowth". J. Neurosci. 29 (23): 7459–73. doi:10.1523/JNEUROSCI.4872-08.2009. PMID 19515914. www.jneurosci.org.</ref> Ook gaat het mogelijk de a-beta-geïnduceerde onderdrukking van de goede werking van NMDA-receptoren tegen.[132][133] Het signaleringspad van het eiwit zou zelfs een ontbrekende schakel kunnen vormen tussen de ziekte van Alzheimer en schizofrenie.[134]
Kanker
Bij tumoren verandert vaak het patroon van de DNA-methylatie. Hierdoor wordt ook het RELN-gen mogelijk beïnvloed. Volgens een studie wordt bij alvleesklierkanker de expressie van reeline onderdrukt, waardoor ook de pathway van het eiwit verstoord raakt. Bij kankercellen die het eiwit nog wel exprimeerden leidde het onderdrukken van deze expressie tot een toegenomen metastase[135]. Bij prostaatkanker blijkt de expressie van reeline daarentegen juist aan de hoge kant te zijn, en bovendien rechtstreeks samen te hangen met een hoge Gleason score[136]. Ook bij retinoblastomen is sprake van een overmatige reeline-expressie.[137]
Andere ziekten
Volgens een genoom-brede associatie studie met 550.0000 enkel-nucleotide polymorfismen speelt mutatie van het reelinegen een rol bij otosclerose.[138] Nieuw onderzoek bij muizen wees uit dat upregulatie van zowel DAB1 als RELN mogelijk een rol speelt bij het beschermen tegen cerebrale malaria.[139]
Reeline en psychofarmaca
Aangezien uit post-mortem onderzoek is gebleken dat reeline bij een groot aantal afwijkingen aan de hersenen is betrokken, is de rol ervan als potentieel geneesmiddel vanzelfsprekend belangrijk.
Volgens de epigenetische hypothese kunnen medicijnen die demethylatie in de hand werken de downregulatie van RELN en GAD67, die mogelijk het gevolg is van methylatie, verminderen. Bij muizen die waren voorbehandeld met I-methionine werd de demethylatie van deze twee genen wel gestimuleerd door een behandeling met clozapine en sulpiride, maar niet door een behandeling met haloperidol en olanzapine.[140]
Valproïnezuur, dat een inhibitor is van histone deacetylase, wordt verondersteld een positieve werking te hebben wanneer het wordt ingenomen in combinatie met antipsychotica. Uit een experiment van Fatemi et al., waarbij gedurende 21 dagen van peritoneale injecties de hoeveelheid RELN mRNA en reeline in de prefrontale cortex van ratten werd gemeten, bleek anderzijds geen sprake te zijn van een verhoogde reeline-expressie als gevolg van valproïnezuur, waaruit volgt dat verder onderzoek op dit gebied nog nodig is. De resultaten van het betreffende experiment waren als volgt:[1]
| Reeline-expressie | Clozapine | Fluoxetine | Haloperidol | Lithium | Olanzapine | Valproïnezuur |
|---|---|---|---|---|---|---|
| proteïne | ↓ | ↔ | ↓ | ↓ | ↑ | ↔ |
| mRNA | ↑ | ↑ | ↓ | ↑ | ↑ | ↓ |
In een nieuwe studie van Fatima et al. werd behalve de corticale expressie van reeline ook die van VLDLR, DAB1, GSK3beta, GAD65 en GAD67 gemeten.[141]
Eksterne verwijzingenen
Aanbevolen literatuur
- Het boek: Fatemi, S. Hossein, Reelin Glycoprotein: Structure, Biology and Roles in Health and Disease. Springfer, Berlin, 2008, p. 444 pages
- Een recensie: Förster E, Jossin Y, Zhao S, Chai X, Frotscher M, Goffinet AM (February 2006). Recent progress in understanding the role of Reelin in radial neuronal migration, with specific emphasis on the dentate gyrus. Eur. J. Neurosci. 23 (4): 901–9. DOI:10.1111/j.1460-9568.2006.04612.x.
Artikels, publicaties, websites
- Gabriella D'Arcangelo. Rutgers University. Geraadpleegd op 2008-08-23.
- www.wikigenes.org
Figuren en afbeeldingen
- Expressie van het reelinegen bij muizen. St. Jude Children’s Research Hospital. Geraadpleegd op 2008-08-23.
- Schematische weergave van de signalen via de receptoren apoER2 en VLDL. Geraadpleegd op 2008-08-23. – Een afbeelding van Beffert U, Stolt PC, Herz J (March 2004). Functions of lipoprotein receptors in neurons. J. Lipid Res. 45 (3): 403–9. DOI:10.1194/jlr.R300017-JLR200.
- Voorgesteld mechanisme dat de afscheiding van reelin bij muizen reguleert. Proc. Natl. Acad. Sci. USA. Geraadpleegd op 2008-08-23. – A figure from Dong E, Agis-Balboa RC, Simonini MV, Grayson DR, Costa E, Guidotti A (August 2005). Reelin and glutamic acid decarboxylase67 promoter remodeling in an epigenetic methionine-induced mouse model of schizophrenia. Proc. Natl. Acad. Sci. U.S.A. 102 (35): 12578–83. DOI:10.1073/pnas.0505394102.
- Corticogenesis bij muizen. Geraadpleegd op 2008-08-23. – A figure from Magdaleno SM, Curran T (December 2001). Brain development: integrins and the Reelin pathway. Curr. Biol. 11 (24): R1032–5. DOI:10.1016/S0960-9822(01)00618-2.
- Effecten van natuurlijke en kunstmatige RELN-mutaties op het voorspelde eiwit.. Nature Genetics. Geraadpleegd op 2008-08-23. Een afbeelding van Hong SE, Shugart YY, Huang DT, et al. (September 2000). Autosomal recessive lissencephaly with cerebellar hypoplasia is associated with human RELN mutations. Nat. Genet. 26 (1): 93–6. DOI:10.1038/79246.
- MRI-analyse. Nature Genetics. Geraadpleegd op 2008-08-23. – Een afbeelding van Hong et al.
| Zoek reeline op in het WikiWoordenboek. |
![]()
![]() Zie ook de categorie met mediabestanden in verband met reeline op Wikimedia Commons.
Zie ook de categorie met mediabestanden in verband met reeline op Wikimedia Commons.
Bronvermelding
Bronnen, noten en/of referenties:
Er zijn meer dan 100 verwijzingen in dit artikel. U kunt in het kader hieronder scrollen om andere verwijzingen te bekijken.
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 (en) Hossein S. Fatemi, ed (2008). Reelin Glycoprotein: Structure, Biology and Roles in Health and Disease. Springer. pp. 444. ISBN 978-0-387-76760-4. www.springer.com
- ↑ 2,0 2,1 Niu S, Renfro A, Quattrocchi CC, Sheldon M, D'Arcangelo G (January 2004). "Reelin promotes hippocampal dendrite development through the VLDLR/ApoER2-Dab1 pathway". Neuron 41 (1): 71–84. doi:10.1016/S0896-6273(03)00819-5. PMID 14715136.
- º (en) Niu S, Yabut O, D'Arcangelo G (October 2008). "The Reelin signaling pathway promotes dendritic spine development in hippocampal neurons". The Journal of neuroscience : the official journal of the Society for Neuroscience 28 (41): 10339–48. doi:10.1523/JNEUROSCI.1917-08.2008. PMID 18842893. www.jneurosci.org.
- ↑ 4,0 4,1 D'Arcangelo G (August 2005). "Apoer2: a reelin receptor to remember". Neuron 47 (4): 471–3. doi:10.1016/j.neuron.2005.08.001. PMID 16102527.
- º (en) www.ias.ac.in

- º www.sciencedirect.com
- º (en) Caviness VS (December 1976). "Patterns of cell and fiber distribution in the neocortex of the reeler mutant mouse". J. Comp. Neurol. 170 (4): 435–47. doi:10.1002/cne.901700404. PMID 1002868.
- º (en) Sheldon M, Rice DS, D'Arcangelo G, et al. (October 1997). "Scrambler and yotari disrupt the disabled gene and produce a reeler-like phenotype in mice". Nature 389 (6652): 730–3. doi:10.1038/39601. PMID 9338784.
- º (en) Quattrocchi CC, Wannenes F, Persico AM, Ciafré SA, D'Arcangelo G, Farace MG, Keller F. (January 2002). "Reelin is a serine protease of the extracellular matrix". J. Biol. Chem. 277 (1): 303–9. doi:10.1074/jbc.M106996200. PMID 11689558
- º Nogi T, Yasui N, Hattori M, Iwasaki K, Takagi J (August 2006). Structure of a signaling-competent reelin fragment revealed by X-ray crystallography and electron tomography. Embo J. 25 (15): 3675–83. DOI:10.1038/sj.emboj.7601240.
- º (en) Royaux I, Lambert de Rouvroit C, D'Arcangelo G, Demirov D, Goffinet AM (December 1997). "Genomic organization of the mouse reelin gene". Genomics 46 (2): 240–50. doi:10.1006/geno.1997.4983. PMID 9417911.
- ↑ 12,0 12,1 (en) Meyer G, Goffinet AM (July 1998). "Prenatal development of reelin-immunoreactive neurons in the human neocortex". J. Comp. Neurol. 397 (1): 29–40. doi:10.1002/(SICI)1096-9861(19980720)397:1<29::AID-CNE3>3.3.CO;2-7. PMID 9671277.
- º (en) Costagli A, Kapsimali M, Wilson SW, Mione M (August 2002). "Conserved and divergent patterns of Reelin expression in the zebrafish central nervous system". J. Comp. Neurol. 450 (1): 73–93. doi:10.1002/cne.10292. PMID 12124768.
- º (en) Pérez-García CG, González-Delgado FJ, Suárez-Solá ML, et al. (January 2001). "Reelin-immunoreactive neurons in the adult vertebrate pallium". J. Chem. Neuroanat. 21 (1): 41–51. doi:10.1016/S0891-0618(00)00104-6. PMID 11173219.
- º (en) Pollard KS, Salama SR, Lambert N, et al. (September 2006). "An RNA gene expressed during cortical development evolved rapidly in humans". Nature 443 (7108): 167–72. doi:10.1038/nature05113. PMID 16915236.
- º (en) Pesold C, Impagnatiello F, Pisu MG, et al. (March 1998). "Reelin is preferentially expressed in neurons synthesizing gamma-aminobutyric acid in cortex and hippocampus of adult rats". Proc. Natl. Acad. Sci. U.S.A. 95 (6): 3221–6. doi:10.1073/pnas.95.6.3221. PMID 9501244.
- º Nakano Y, Kohno T, Hibi T, et al. (July 2007). The extremely conserved C-terminal region of Reelin is not necessary for secretion but is required for efficient activation of downstream signaling. J. Biol. Chem. 282 (28): 20544–52. DOI:10.1074/jbc.M702300200.
- º www.sciencedirect.com
- º (en) www.ncbi.nlm.nih.gov
- º www.ncbi.nlm.nih.gov
- º Smit-Rigter LA, Champagne DL, van Hooft JA (2009). "Lifelong impact of variations in maternal care on dendritic structure and function of cortical layer 2/3 pyramidal neurons in rat offspring". PLoS ONE 4 (4): e5167. doi:10.1371/journal.pone.0005167. PMID 19357777. PMC 2663818. dx.plos.org.
- º (en) www.sciencedirect.com
- º (en) www.cell.com
- º (en) Andersen, Olav M; Benhayon David, Curran Tom, Willnow Thomas E (Aug. 2003). "Differential binding of ligands to the apolipoprotein E receptor 2". Biochemistry (United States) 42 (31): 9355-64. doi:10.1021/bi034475p. ISSN 0006-2960. PMID 12899622.
- º (en) Strasser V, Fasching D, Hauser C, et al. (February 2004). "Receptor clustering is involved in Reelin signaling". Molecular and cellular biology 24 (3): 1378–86. doi:10.1128/MCB.24.3.1378-1386.2004. PMID 14729980. PMC 321426. mcb.asm.org
- º (en) Hack I, Hellwig S, Junghans D, Brunne B, Bock HH, Zhao S, Frotscher M (2007). "Divergent roles of ApoER2 and Vldlr in the migration of cortical neurons". Development 134 (21): 3883–91. doi:10.1242/dev.005447. PMID 17913789.
- º (en) Beffert U, Weeber EJ, Durudas A, et al. (August 2005). "Modulation of synaptic plasticity and memory by Reelin involves differential splicing of the lipoprotein receptor Apoer2" (PDF). Neuron 47 (4): 567–79. doi:10.1016/j.neuron.2005.07.007. PMID 16102539. jax.herzlab.org
 .
.
- ↑ 28,0 28,1 (en) Hartfuss E, Förster E, Bock HH, et al. (October 2003). "Reelin signaling directly affects radial glia morphology and biochemical maturation". Development 130 (19): 4597–609. doi:10.1242/dev.00654. PMID 12925587.
- º (en) Belvindrah R, Graus-Porta D, Goebbels S, Nave KA, Müller U (December 2007). "Beta1 integrins in radial glia but not in migrating neurons are essential for the formation of cell layers in the cerebral cortex". J. Neurosci. 27 (50): 13854–65. doi:10.1523/JNEUROSCI.4494-07.2007. PMID 18077697.
- º (en) Utsunomiya-Tate N, Kubo K, Tate S, et al. (August 2000). "Reelin molecules assemble together to form a large protein complex, which is inhibited by the function-blocking CR-50 antibody". Proc. Natl. Acad. Sci. U.S.A. 97 (17): 9729–34. doi:10.1073/pnas.160272497. PMID 10920200.
- º Kubo K, Mikoshiba K, Nakajima K (August 2002). "Secreted Reelin molecules form homodimers". Neurosci. Res. 43 (4): 381–8. doi:10.1016/S0168-0102(02)00068-8. PMID 12135781.
- º (en) Howell BW, Gertler FB, Cooper JA (January 1997). "Mouse disabled (mDab1): a Src binding protein implicated in neuronal development". Embo J. 16 (1): 121–32. doi:10.1093/emboj/16.1.121. PMID 9009273. 72.
- º (en) Arnaud L, Ballif BA, Förster E, Cooper JA (January 2003). "Fyn tyrosine kinase is a critical regulator of disabled-1 during brain development". Curr. Biol. 13 (1): 9–17. doi:10.1016/S0960-9822(02)01397-0. PMID 12526739. [http://linkinghub.elsevier.com/retrieve/pii/S0960982202013970 linkinghub.elsevier.com}}
- º (en) Feng L, Allen NS, Simo S, Cooper JA (November 2007). "Cullin 5 regulates Dab1 protein levels and neuron positioning during cortical development". Genes Dev. 21 (21): 2717–30. doi:10.1101/gad.1604207. PMID 17974915.
- º (en) Kerjan G, Gleeson JG (November 2007). "A missed exit: Reelin sets in motion Dab1 polyubiquitination to put the break on neuronal migration". Genes Dev. 21 (22): 2850–4. doi:10.1101/gad.1622907. PMID 18006681.
- ↑ 36,0 36,1 Jossin Y, Ignatova N, Hiesberger T, Herz J, Lambert de Rouvroit C, Goffinet AM (January 2004). "The central fragment of Reelin, generated by proteolytic processing in vivo, is critical to its function during cortical plate development". J. Neurosci. 24 (2): 514–21. doi:10.1523/JNEUROSCI.3408-03.2004. PMID 14724251.
- º (en) Miller CA, Sweatt JD (March 2007). "Covalent modification of DNA regulates memory formation". Neuron 53 (6): 857–69. doi:10.1016/j.neuron.2007.02.022. PMID 17359920.
- º (en) Jossin Y, Ignatova N, Hiesberger T, Herz J, Lambert de Rouvroit C, Goffinet AM (januari 2004). "The central fragment of Reelin, generated by proteolytic processing in vivo, is critical to its function during cortical plate development". J. Neurosci. 24 (2): 514–21. doi:10.1523/JNEUROSCI.3408-03.2004. PMID 14724251
- º (en) Arnaud L, Ballif BA, Cooper JA (December 2003). "Regulation of protein tyrosine kinase signaling by substrate degradation during brain development". Mol. Cell. Biol. 23 (24): 9293–302. doi:10.1128/MCB.23.24.9293-9302.2003. PMID 14645539. PMC: 309695. mcb.asm.org.
- º (en) Kobayashi S, Ishiguro K, Omori A, Takamatsu M, Arioka M, Imahori K, Uchida T (December 1993). "A cdc2-related kinase PSSALRE/cdk5 is homologous with the 30 kDa subunit of tau protein kinase II, a proline-directed protein kinase associated with microtubule". FEBS Lett. 335 (2): 171–5. doi:10.1016/0014-5793(93)80723-8. PMID 8253190. linkinghub.elsevier.com.
- º (en) Beffert U, Morfini G, Bock HH, Reyna H, Brady ST, Herz J (December 2002). "Reelin-mediated signaling locally regulates protein kinase B/Akt and glycogen synthase kinase 3beta". J. Biol. Chem. 277 (51): 49958–64. doi:10.1074/jbc.M209205200. PMID 12376533. www.jbc.org.
- º (en) Sasaki S, Shionoya A, Ishida M, Gambello MJ, Yingling J, Wynshaw-Boris A, Hirotsune S (December 2000). "A LIS1/NUDEL/cytoplasmic dynein heavy chain complex in the developing and adult nervous system". Neuron 28 (3): 681–96. doi:10.1016/S0896-6273(00)00146-X. PMID 11163259. linkinghub.elsevier.com.
- º (en) Quattrocchi CC, Wannenes F, Persico AM, Ciafré SA, D'Arcangelo G, Farace MG, Keller F. (January 2002). "Reelin is a serine protease of the extracellular matrix". J. Biol. Chem. 277 (1): 303–9. doi:10.1074/jbc.M106996200. PMID 11689558.
- º (en) Zhang G, Assadi AH, McNeil RS, Beffert U, Wynshaw-Boris A, Herz J, Clark GD, D’Arcangelo G. (2007). "The Pafah1b complex interacts with the Reelin receptor VLDLR". PLoS ONE 2 (2): e252. doi:10.1371/journal.pone.0000252. PMID 17330141.
- º (en) www.rndsystems.com
- º (en) Senzaki K, Ogawa M, Yagi T (December 1999). "Proteins of the CNR family are multiple receptors for Reelin". Cell 99 (6): 635–47. doi:10.1016/S0092-8674(00)81552-4. PMID 10612399.
- º name="pmid17442808">Jossin Y, Gui L, Goffinet AM (April 2007). Processing of Reelin by embryonic neurons is important for function in tissue but not in dissociated cultured neurons. J. Neurosci. 27 (16): 4243–52. DOI:10.1523/JNEUROSCI.0023-07.2007.
- º (en) Keilani S, Sugaya K (July 2008). "Reelin induces a radial glial phenotype in human neural progenitor cells by activation of Notch-1". BMC Dev. Biol. 8 (1): 69. doi:10.1186/1471-213X-8-69. PMID 18593473.
- ↑ 49,0 49,1 Jossin Y, Gui L, Goffinet AM (April 2007). "Processing of Reelin by embryonic neurons is important for function in tissue but not in dissociated cultured neurons". J. Neurosci. 27 (16): 4243–52. doi:10.1523/JNEUROSCI.0023-07.2007. PMID 17442808.
- º (en) Lugli G, Krueger JM, Davis JM, Persico AM, Keller F, Smalheiser NR (September 2003). "Methodological factors influencing measurement and processing of plasma reelin in humans". BMC Biochem. 4: 9. doi:10.1186/1471-2091-4-9. PMID 12959647.
- º (en) Hibi T, Hattori M (March 2009). "The N-terminal fragment of Reelin is generated after endocytosis and released through the pathway regulated by Rab11". FEBS Lett.. doi:10.1016/j.febslet.2009.03.024. PMID 19303411. linkinghub.elsevier.com.
- º (en) Chameau P, Inta D, Vitalis T, Monyer H, Wadman WJ, van Hooft JA (April 2009). "The N-terminal region of reelin regulates postnatal dendritic maturation of cortical pyramidal neurons". Proc. Natl. Acad. Sci. U.S.A.. doi:10.1073/pnas.0810764106. PMID 19366679. www.pnas.org.
- º Frotscher M, Chai X, Bock HH, Haas CA, Förster E, Zhao S (April 2009). "Role of Reelin in the development and maintenance of cortical lamination". J Neural Transm. doi:10.1007/s00702-009-0228-7. PMID 19396394. dx.doi.org.
- º (en) www.jneurosci.org
- ↑ 55,0 55,1 (en) Kobold D, Grundmann A, Piscaglia F, et al. (May 2002). "Expression of reelin in hepatic stellate cells and during hepatic tissue repair: a novel marker for the differentiation of HSC from other liver myofibroblasts". J. Hepatol. 36 (5): 607–13. doi:10.1016/S0168-8278(02)00050-8. PMID 11983443.
- º (en) Pulido JS, Sugaya I, Comstock J, Sugaya K (June 2007). "Reelin expression is upregulated following ocular tissue injury". Graefes Arch. Clin. Exp. Ophthalmol. 245 (6): 889–93. doi:10.1007/s00417-006-0458-4. PMID 17120005.
- º (en) Nomura T, Takahashi M, Hara Y, Osumi N (2008). "Patterns of neurogenesis and amplitude of Reelin expression are essential for making a mammalian-type cortex". PLoS ONE 3 (1): e1454. doi:10.1371/journal.pone.0001454. PMID 18197264.
- º (en) A role for Cajal-Retzius cells and reelin in the development of hippocampal connections. Del Río JA, Heimrich B, Borrell V, Förster E, Drakew A, Alcántara S, Nakajima K, Miyata T, Ogawa M, Mikoshiba K, Derer P, Frotscher M, Soriano E. Nature. 1997 Jan 2;385(6611):70-4. PMID 8985248
- º (en) Andrade N, Komnenovic V, Blake SM, et al. (May 2007). "ApoER2/VLDL receptor and Dab1 in the rostral migratory stream function in postnatal neuronal migration independently of Reelin". Proceedings of the National Academy of Sciences of the United States of America 104 (20): 8508–13. doi:10.1073/pnas.0611391104. PMID 17494763. PMC: 1895980. www.pnas.org.
- º (en) Blake SM, Strasser V, Andrade N, et al. (October 2008). "Thrombospondin-1 binds to ApoER2 and VLDL receptor and functions in postnatal neuronal migration". The EMBO journal 27: 3069. doi:10.1038/emboj.2008.223. PMID 18946489
- º (en) Frotscher M, Haas CA, Förster E (June 2003). "Reelin controls granule cell migration in the dentate gyrus by acting on the radial glial scaffold". Cereb. Cortex 13 (6): 634–40. doi:10.1093/cercor/13.6.634. PMID 12764039.
- º (en) Maurin JC, Couble ML, Didier-Bazes M, Brisson C, Magloire H, Bleicher F (August 2004). "Expression and localization of reelin in human odontoblasts". Matrix biology : journal of the International Society for Matrix Biology 23 (5): 277–85. doi:10.1016/j.matbio.2004.06.005. PMID 15464360. linkinghub.elsevier.com
- º Sinagra M, Verrier D, Frankova D, Korwek KM, Blahos J, Weeber EJ, Manzoni OJ, Chavis P (June 2005). "Reelin, very-low-density lipoprotein receptor, and apolipoprotein E receptor 2 control somatic NMDA receptor composition during hippocampal maturation in vitro". J. Neurosci. 25 (26): 6127–36. doi:10.1523/JNEUROSCI.1757-05.2005. PMID 15987942. www.jneurosci.org.
- ↑ 64,0 64,1 Groc L, Choquet D, Stephenson FA, Verrier D, Manzoni OJ, Chavis P (2007). "NMDA receptor surface trafficking and synaptic subunit composition are developmentally regulated by the extracellular matrix protein Reelin". J. Neurosci. 27 (38): 10165–75. doi:10.1523/JNEUROSCI.1772-07.2007. PMID 17881522.
- º Liu XB, Murray KD, Jones EG (October 2004). "Switching of NMDA receptor 2A and 2B subunits at thalamic and cortical synapses during early postnatal development". J. Neurosci. 24 (40): 8885–95. doi:10.1523/JNEUROSCI.2476-04.2004. PMID 15470155. www.jneurosci.org.
- ↑ 66,0 66,1 (en) Matsuki T, Pramatarova A, Howell BW (May 2008). "Reduction of Crk and CrkL expression blocks reelin-induced dendritogenesis". J. Cell. Sci. 121: 1869. doi:10.1242/jcs.027334. PMID 18477607.
- º (en) Ballif BA, Arnaud L, Arthur WT, Guris D, Imamoto A, Cooper JA (Apr 2004). "Activation of a Dab1/CrkL/C3G/Rap1 pathway in Reelin-stimulated neurons". Curr. Biol. 14 (7): 606-10. doi:10.1016/j.cub.2004.03.038. PMID 15062102.
- º Park TJ, Curran T (December 2008). "Crk and crk-like play essential overlapping roles downstream of disabled-1 in the reelin pathway". J. Neurosci. 28 (50): 13551–62. doi:10.1523/JNEUROSCI.4323-08.2008. PMID 19074029.
- º www.ntvg.nl
- º (en) interscience.wiley.com
- º (en) www.pnas.org
- ↑ 72,0 72,1 (en) Hack I, Bancila M, Loulier K, Carroll P, Cremer H (October 2002). "Reelin is a detachment signal in tangential chain-migration during postnatal neurogenesis". Nat. Neurosci. 5 (10): 939–45. doi:10.1038/nn923. PMID 12244323.
- º interscience.wiley.com
- º Yoshida M, Assimacopoulos S, Jones KR, Grove EA (February 2006). "Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order". Development 133 (3): 537–45. doi:10.1242/dev.02209. PMID 16410414.
- ↑ 75,0 75,1 (en) Yoshida M, Assimacopoulos S, Jones KR, Grove EA (February 2006). "Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order". Development 133 (3): 537–45. doi:10.1242/dev.02209. PMID 16410414.
- º (en) www.pnas.org
- º (en) Yip YP, Mehta N, Magdaleno S, Curran T, Yip JW (March 2009). "Ectopic expression of reelin alters migration of sympathetic preganglionic neurons in the spinal cord". J. Comp. Neurol. 515 (2): 260–268. doi:10.1002/cne.22044. PMID 19412957. dx.doi.org.
- º (en) Bar I, Lambert de Rouvroit C, Goffinet AM (December 2000). "The evolution of cortical development. An hypothesis based on the role of the Reelin signaling pathway". Trends Neurosci. 23 (12): 633–8. doi:10.1016/S0166-2236(00)01675-1. PMID 11137154.
- º (en) Molnár Z, Métin C, Stoykova A, et al. (February 2006). "Comparative aspects of cerebral cortical development". Eur. J. Neurosci. 23 (4): 921–34. doi:10.1111/j.1460-9568.2006.04611.x. PMID 16519657
- º (en) Nomura T, Takahashi M, Hara Y, Osumi N (2008). "Patterns of neurogenesis and amplitude of Reelin expression are essential for making a mammalian-type cortex". PLoS ONE 3 (1): e1454. doi:10.1371/journal.pone.0001454. PMID 18197264
- º (en) ncbi.nlm.nih.gov
- º (en) Williamson SH, Hubisz MJ, Clark AG, Payseur BA, Bustamante CD, Nielsen R (2007). "Localizing Recent Adaptive Evolution in the Human Genome". PLoS Genetics 3 (6): e90. doi:10.1371/journal.pgen.0030090. PMID 17542651.
- º (en) Wade N (2007-06-26). "Humans Have Spread Globally, and Evolved Locally". Science. New York Times. www.nytimes.com. Retrieved 2008-08-23.
- º (en) Zaki M, Shehab M, El-Aleem AA, et al. (May 2007). "Identification of a novel recessive RELN mutation using a homozygous balanced reciprocal translocation". Am. J. Med. Genet. A 143A (9): 939–44. doi:10.1002/ajmg.a.31667. PMID 17431900.
- º (en) Guidotti A, Ruzicka W, Grayson DR, et al. (January 2007). "S-adenosyl methionine and DNA methyltransferase-1 mRNA overexpression in psychosis". Neuroreport 18 (1): 57–60. doi:10.1097/WNR.0b013e32800fefd7. PMID 17259861.
- º (en) Grayson DR, Jia X, Chen Y, et al. (June 2005). "Reelin promoter hypermethylation in schizophrenia". Proc. Natl. Acad. Sci. U.S.A. 102 (26): 9341–6. doi:10.1073/pnas.0503736102. PMID 15961543.
- º (en) Pollin W, Cardon PV, Kety SS (January 1961). "Effects of amino acid feedings in schizophrenic patients treated with iproniazid". Science (journal) 133: 104–5. doi:10.1126/science.133.3446.104. PMID 13736870.
- º (en) Brune GG, Himwich HE (May 1962). "Effects of methionine loading on the behavior of schizophrenic patients". J. Nerv. Ment. Dis. 134: 447–50. doi:10.1097/00005053-196205000-00007. PMID 13873983.
- º (en) Park L, Baldessarini RJ, Kety SS (April 1965). "Effects of methionine ingestion in chronic schizophrenia patients treated with monoamine oxidase inhibitors". Arch. Gen. Psychiatry 12: 346–51. PMID 14258360.
- º (en) Antun FT, Burnett GB, Cooper AJ, Daly RJ, Smythies JR, Zealley AK (June 1971). "The effects of L-methionine (without MAOI) in schizophrenia". J Psychiatr Res 8 (2): 63–71. doi:10.1016/0022-3956(71)90009-4. PMID 4932991.
- º (en) Ruzicka WB, Zhubi A, Veldic M, Grayson DR, Costa E, Guidotti A (April 2007). "Selective epigenetic alteration of layer I GABAergic neurons isolated from prefrontal cortex of schizophrenia patients using laser-assisted microdissection". Mol. Psychiatry 12 (4): 385–97. doi:10.1038/sj.mp.4001954. PMID 17264840.
- º (en) Veldic M, Caruncho HJ, Liu WS, Davis J, Satta R, Grayson DR, Guidotti A, Costa E (January 2004). "DNA-methyltransferase 1 mRNA is selectively overexpressed in telencephalic GABAergic interneurons of schizophrenia brains". Proc. Natl. Acad. Sci. U.S.A. 101 (1): 348–53. doi:10.1073/pnas.2637013100. PMID 14684836.
- º (en) Tremolizzo L, Doueiri MS, Dong E, et al. (March 2005). "Valproate corrects the schizophrenia-like epigenetic behavioral modifications induced by methionine in mice". Biol. Psychiatry 57 (5): 500–9. doi:10.1016/j.biopsych.2004.11.046. PMID 15737665.
- º Chen Y, Sharma RP, Costa RH, Costa E, Grayson DR (July 2002). "On the epigenetic regulation of the human reelin promoter". Nucleic Acids Res. 30 (13): 2930–9. doi:10.1093/nar/gkf401. PMID 12087179.
- º Mitchell CP, Chen Y, Kundakovic M, Costa E, Grayson DR (April 2005). "Histone deacetylase inhibitors decrease reelin promoter methylation in vitro". J. Neurochem. 93 (2): 483–92. doi:10.1111/j.1471-4159.2005.03040.x. PMID 15816871.
- º Tremolizzo L, Carboni G, Ruzicka WB, et al. (December 2002). "An epigenetic mouse model for molecular and behavioral neuropathologies related to schizophrenia vulnerability". Proc. Natl. Acad. Sci. U.S.A. 99 (26): 17095–100. doi:10.1073/pnas.262658999. PMID 12481028.
- º Kundakovic M, Chen Y, Costa E, Grayson DR (March 2007). "DNA methyltransferase inhibitors coordinately induce expression of the human reelin and glutamic acid decarboxylase 67 genes". Mol. Pharmacol. 71 (3): 644–53. doi:10.1124/mol.106.030635. PMID 17065238.
- º Kundakovic M, Chen Y, Guidotti A, Grayson DR (November 2008). "The reelin and GAD67 promoters are activated by epigenetic drugs that facilitate the disruption of local repressor complexes". Mol. Pharmacol. 75: 342. doi:10.1124/mol.108.051763. PMID 19029285. molpharm.aspetjournals.org.
- º (en) www.schizophreniaforum.org
- º Fatemi SH, Emamian ES, Kist D, Sidwell RW, Nakajima K, Akhter P, Shier A, Sheikh S, Bailey K (March 1999). "Defective corticogenesis and reduction in Reelin immunoreactivity in cortex and hippocampus of prenatally infected neonatal mice". Mol. Psychiatry 4 (2): 145–54. doi:10.1038/sj.mp.4000520. PMID 10208446.
- º (en) Meyer U, Nyffeler M, Yee BK, Knuesel I, Feldon J (2007). "Adult brain and behavioral pathological markers of prenatal immune challenge during early/middle and late fetal development in mice". Brain Behav Immun 22: 469. doi:10.1016/j.bbi.2007.09.012. PMID 18023140.
- º (en) Tochigi M, Iwamoto K, Bundo M, Komori A, Sasaki T, Kato N, Kato T (2007). "Methylation Status of the Reelin Promoter Region in the Brain of Schizophrenic Patients". Biological Psychiatry 63: 530. doi:10.1016/j.biopsych.2007.07.003. PMID 17870056.
- º (en) Mill J, Tang T, Kaminsky Z, Khare T, Yazdanpanah S, Bouchard L, Jia P, Assadzadeh A, Flanagan J, Schumacher A, Wang SC, Petronis A (2008). "Epigenomic profiling reveals DNA-methylation changes associated with major psychosis". Am. J. Hum. Genet. 82 (3): 696–711. doi:10.1016/j.ajhg.2008.01.008. PMID 18319075.
- ↑ 104,0 104,1 Wedenoja J, Loukola A, Tuulio-Henriksson A, Paunio T, Ekelund J, Silander K, Varilo T, Heikkilä K, Suvisaari J, Partonen T, Lönnqvist J, Peltonen L (2007). "Replication of linkage on chromosome 7q22 and association of the regional Reelin gene with working memory in schizophrenia families". Mol Psychiatry 13: 673. doi:10.1038/sj.mp.4002047. PMID 17684500.
- º (en) Shifman S, Johannesson M, Bronstein M, Chen SX, Collier DA, Craddock NJ, Kendler KS, Li T, O'Donovan M, O'Neill FA, Owen MJ, Walsh D, Weinberger DR, Sun C, Flint J, Darvasi A (2008). "Genome-Wide Association Identifies a Common Variant in the Reelin Gene That Increases the Risk of Schizophrenia Only in Women". PLoS Genet. 4 (2): e28.
- º (en) Gregório SP, Sallet PC, Do KA, Lin E, Gattaz WF, Dias-Neto E (December 2008). "Polymorphisms in genes involved in neurodevelopment may be associated with altered brain morphology in schizophrenia: Preliminary evidence". Psychiatry Res 165: 1. doi:10.1016/j.psychres.2007.08.011. PMID 19054571. linkinghub.elsevier.com.
- º Sweet RA, Henteleff RA, Zhang W, Sampson AR, Lewis DA (May 2008). "Reduced Dendritic Spine Density in Auditory Cortex of Subjects with Schizophrenia". Neuropsychopharmacology 34: 374. doi:10.1038/npp.2008.67. PMID 18463626.
- º (en) Glantz LA, Lewis DA (January 2000). "Decreased dendritic spine density on prefrontal cortical pyramidal neurons in schizophrenia". Arch. Gen. Psychiatry 57 (1): 65–73. doi:10.1001/archpsyc.57.1.65. PMID 10632234.
- º (en) Rodriguez MA, Pesold C, Liu WS, et al. (March 2000). "Colocalization of integrin receptors and reelin in dendritic spine postsynaptic densities of adult nonhuman primate cortex". Proc. Natl. Acad. Sci. U.S.A. 97 (7): 3550–5. doi:10.1073/pnas.050589797. PMID 10725376.
- º (en) Costa E, Davis J, Grayson DR, Guidotti A, Pappas GD, Pesold C (October 2001). "Dendritic spine hypoplasticity and downregulation of reelin and GABAergic tone in schizophrenia
- ↑ 111,0 111,1 Suzuki K, Nakamura K, Iwata Y, Sekine Y, Kawai M, Sugihara G, Tsuchiya KJ, Suda S, Matsuzaki H, Takei N, Hashimoto K, Mori N (2007). "Decreased expression of reelin receptor VLDLR in peripheral lymphocytes of drug-naive schizophrenic patients". Schizophrenia Research 98: 148. doi:10.1016/j.schres.2007.09.029. PMID 17936586.
- º Kamnasaran D, Muir WJ, Ferguson-Smith MA, Cox DW (May 2003). "Disruption of the neuronal PAS3 gene in a family affected with schizophrenia". J. Med. Genet. 40 (5): 325–32. doi:10.1136/jmg.40.5.325. PMID 12746393.
- º (en) Erbel-Sieler C, Dudley C, Zhou Y, et al. (September 2004). "Behavioral and regulatory abnormalities in mice deficient in the NPAS1 and NPAS3 transcription factors". Proc. Natl. Acad. Sci. U.S.A. 101 (37): 13648–53. doi:10.1073/pnas.0405310101. PMID 15347806.
- º Chen Z, Schwahn BC, Wu Q, He X, Rozen R (August 2005). "Postnatal cerebellar defects in mice deficient in methylenetetrahydrofolate reductase". Int. J. Dev. Neurosci. 23 (5): 465–74. doi:10.1016/j.ijdevneu.2005.05.007. PMID 15979267.
- º (en) Gene Overview of All Published Schizophrenia-Association Studies for GRIN2B - Schizophrenia Gene Database.
- º (en) Wang GS, Hong CJ, Yen TY, Huang HY, Ou Y, Huang TN, Jung WG, Kuo TY, Sheng M, Wang TF, Hsueh YP (April 2004). "Transcriptional modification by a CASK-interacting nucleosome assembly protein". Neuron 42 (1): 113–28. PMID 15066269. linkinghub.elsevier.com.
- º Pappas GD, Kriho V, Pesold C (May 2001). "Reelin in the extracellular matrix and dendritic spines of the cortex and hippocampus: a comparison between wild type and heterozygous reeler mice by immunoelectron microscopy". J. Neurocytol. 30 (5): 413–25. doi:10.1023/A:1015017710332. PMID 11951052.
- º (en) Podhorna J, Didriksen M (August 2004). "The heterozygous reeler mouse: behavioural phenotype". Behav. Brain Res. 153 (1): 43–54. doi:10.1016/j.bbr.2003.10.033. PMID 15219705.
- º (en) Specific association of the reelin gene with bipolar disorder. Goes FS, Willour VL, Zandi PP, Belmonte PL, Mackinnon DF, Mondimore FM, Schweizer B, Depaulo JR Jr, Gershon ES, McMahon FJ, Potash JB; National Institute of Mental Health Genetics Initiative Bipolar Disorder Consortium. Am J Med Genet B Neuropsychiatr Genet. 2009 Aug 18. [Epub ahead of print] PMID 19691043
- º (en) www.sciencedirect.com
- º (en) Pardo CA, Eberhart CG (October 2007). "The neurobiology of autism". Brain Pathol. 17 (4): 434–47. doi:10.1111/j.1750-3639.2007.00102.x. PMID 17919129.
- º (en) Haas CA, Dudeck O, Kirsch M, et al. (July 2002). "Role for reelin in the development of granule cell dispersion in temporal lobe epilepsy". J. Neurosci. 22 (14): 5797–802. doi:20026621 (inactive 2008-07-08). PMID 12122039.
- º Heinrich C, Nitta N, Flubacher A, et al. (April 2006). "Reelin deficiency and displacement of mature neurons, but not neurogenesis, underlie the formation of granule cell dispersion in the epileptic hippocampus". J. Neurosci. 26 (17): 4701–13. doi:10.1523/JNEUROSCI.5516-05.2006. PMID 16641251.
- º (en) www.ncbi.nlm.nih.gov
- º (en) Gong C, Wang TW, Huang HS, Parent JM (February 2007). "Reelin regulates neuronal progenitor migration in intact and epileptic hippocampus". J. Neurosci. 27 (8): 1803–11. doi:10.1523/JNEUROSCI.3111-06.2007. PMID 17314278.
- º (en) Müller MC, Osswald M, Tinnes S, Häussler U, Jacobi A, Förster E, Frotscher M, Haas CA (January 2009). "Exogenous reelin prevents granule cell dispersion in experimental epilepsy". Exp. Neurol. 216: 390. doi:10.1016/j.expneurol.2008.12.029. PMID 19185570. linkinghub.elsevier.com.
- º (en) Botella-López A, Burgaya F, Gavín R, et al. (April 2006). "Reelin expression and glycosylation patterns are altered in Alzheimer's disease". Proc. Natl. Acad. Sci. U.S.A. 103 (14): 5573–8. doi:10.1073/pnas.0601279103. PMID 16567613.
- º (en) Wirths O, Multhaup G, Czech C, et al. (December 2001). "Reelin in plaques of beta-amyloid precursor protein and presenilin-1 double-transgenic mice". Neurosci. Lett. 316 (3): 145–8. doi:10.1016/S0304-3940(01)02399-0. PMID 11744223.
- º Baloyannis SJ (July 2005). "Morphological and morphometric alterations of Cajal-Retzius cells in early cases of Alzheimer's disease: a Golgi and electron microscope study". Int. J. Neurosci. 115 (7): 965–80. doi:10.1080/00207450590901396. PMID 16051543.
- º (en) Baloyannis SJ, Costa V, Mauroudis I, Psaroulis D, Manolides SL, Manolides LS (April 2007). "Dendritic and spinal pathology in the acoustic cortex in Alzheimer's disease: morphological and morphometric estimation by Golgi technique and electron microscopy". Acta Otolaryngol. 127 (4): 351–4. doi:10.1080/00016480601126986. PMID 17453452.
- º (en) Seripa D, Matera MG, Franceschi M, et al. (July 2008). "The RELN locus in Alzheimer's disease". J. Alzheimers Dis. 14 (3): 335–44. PMID 18599960. iospress.metapress.com.
- º (en) www.ncbi.nlm.nih.gov
- º www.sciencecentric.com
- º (en) Aoki, Takeya; Mizuki, Yasushi; Terashima, Toshio Relation between schizophrenia and Alzheimer's disease: the reelin signaling pathway Psychogeriatrics, Volume 5, Number 2, June 2005 , pp. 42-47(6)
- º (en) Sato N, Fukushima N, Chang R, Matsubayashi H, Goggins M. (2006) Differential and epigenetic gene expression profiling identifies frequent disruption of the RELN pathway in pancreatic cancers. Gastroenterology. 130(2):548-65. PMID 16472607
- º (en) Perrone G, Vincenzi B, Zagami M, Santini D, Panteri R, Flammia G, Verzi A, Lepanto D, Morini S, Russo A, Bazan V, Tomasino RM, Morello V, Tonini G, Rabitti C. (2007) Reelin expression in human prostate cancer: a marker of tumor aggressiveness based on correlation with grade. Modern Pathology. doi:10.1038/modpathol.3800743. PMID 17277764
- º (en) Seigel GM, Hackam AS, Ganguly A, Mandell LM, Gonzalez-Fernandez F (2007). "Human embryonic and neuronal stem cell markers in retinoblastoma". Mol. Vis. 13: 823–32. PMID 17615543. www.molvis.org.
- º (en) Schrauwen I, Ealy M, Huentelman MJ, Thys M, Homer N, Vanderstraeten K, Fransen E, Corneveaux JJ, Craig DW, Claustres M, Cremers CW, Dhooge I, Van de Heyning P, Vincent R, Offeciers E, Smith RJ, Van Camp G (February 2009). "A Genome-wide Analysis Identifies Genetic Variants in the RELN Gene Associated with Otosclerosis". Am. J. Hum. Genet. 84: 328. doi:10.1016/j.ajhg.2009.01.023. PMID 19230858.
- º (en) Delahaye NF, Coltel N, Puthier D, Barbier M, Benech P, Joly F, Iraqi FA, Grau GE, Nguyen C, Rihet P (2007). "Gene expression analysis reveals early changes in several molecular pathways in cerebral malaria-susceptible mice versus cerebral malaria-resistant mice". BMC Genomics 8: 452. doi:10.1186/1471-2164-8-452. PMID 18062806. PMC 2246131. www.biomedcentral.com.
- º (en) www.pnas.org
- º (en) Fatemi SH, Reutiman TJ, Folsom TD (April 2009). "Chronic psychotropic drug treatment causes differential expression of Reelin signaling system in frontal cortex of rats". Schizophr. Res.. doi:10.1016/j.schres.2009.03.002. PMID 19359144. linkinghub.elsevier.com.
