Wikisage is op 1 na de grootste internet-encyclopedie in het Nederlands. Iedereen kan de hier verzamelde kennis gratis gebruiken, zonder storende advertenties. De Koninklijke Bibliotheek van Nederland heeft Wikisage in 2018 aangemerkt als digitaal erfgoed.
- Wilt u meehelpen om Wikisage te laten groeien? Maak dan een account aan. U bent van harte welkom. Zie: Portaal:Gebruikers.
- Bent u blij met Wikisage, of wilt u juist meer? Dan stellen we een bescheiden donatie om de kosten te bestrijden zeer op prijs. Zie: Portaal:Donaties.
Reeline: verschil tussen versies
(tekst wat herschreven, losgemaakt van wikipedia) |
Label: Ongedaan maken |
||
| (14 tussenliggende versies door 2 gebruikers niet weergegeven) | |||
| Regel 1: | Regel 1: | ||
'''Reeline''' ( | {{Infobox proteïne | ||
| Naam = Reeline | |||
| Ondertitel = [[Kristallografie|Kristallografische]] structuur van reeline. | |||
| Afbeelding = 2DDU.png | |||
| Width = | |||
| HGNCid = 9957 | |||
| Symbool= RELN | |||
| AltSymbolen = RL | |||
| EntrezGene = 5649 | |||
| OMIM = 600514 | |||
| RefSeq = NM_005045 | |||
| UniProt = P78509 | |||
| PDB = 2ddu | |||
| ECnumber = 3.4.21.- | |||
| Chromosoom = 7<!--Oplossen via redirect--> | |||
| Arm = q | |||
| Band = 22 | |||
| LocusSupplementaryData = | |||
}} | |||
'''Reeline''' is een [[Eiwitten|eiwit]] dat behoort tot de [[glycoproteïne|glycoproteïnen]]. Het wordt voornamelijk afgescheiden in de [[hersenen]] van [[gewervelden]] en zorgt daar gedurende de embryonale ontwikkeling voor een correcte migratie van de [[Gliacel|gliacellen]] en vervolgens ook van de [[Zenuwcel|neuronen]] naar de verschillende lagen in de [[neocortex]]. Wanneer het gen voor reeline of dat van zijn [[Receptor (biochemie)|receptoren]] muteert of sterk wordt [[Methylering|gemethyleerd]], waardoor de expressie van reeline of haar receptoren aanzienlijk daalt, verloopt de [[Celmigratie|migratie]] en [[Celdifferentiatie|differentiatie]] van de neuronen niet goed en doen zich afwijkingen voor in de ontwikkeling van de [[hersenschors]]. Als gevolg daarvan worden de lagen in de hersenschors in de verkeerde volgorde op elkaar gestapeld en hebben ze niet de correcte structuur. De naam reeline is afgeleid van het Engelse werkwoord ''to reel'', wat 'wankelen' betekent en verwijst naar de gevolgen van afwijkingen van het RELN-gen bij muizen die hierdoor waggelend gingen lopen. De afwijkende structuur in de hersenen heeft bij mensen zeer ernstige gevolgen voor de mentale gezondheid en kan zich uiten in [[Bipolaire stoornis|bipolaire stoornissen]], [[schizofrenie]], [[lissencefalie]], [[Depressie (klinisch)|depressies]], [[autisme]] en de [[ziekte van Alzheimer]].<ref>{{Citeer tijdschrift |achternaam=Fatemi |voornaam=S. H. |titel=Reelin glycoprotein: structure, biology and roles in health and disease |url=https://www.nature.com/articles/4001613 |jaargang=10 |tijdschrift=Molecular Psychiatry |datum=2005-03 |taal=en |nummer=3 |doi=10.1038/sj.mp.4001613 |issn=1476-5578 |pagina's=251–257}}</ref> | |||
== Rol == | |||
Gedurende de embryonale ontwikkeling van [[zoogdieren]], [[reptielen]] en [[vogels]] speelt reeline een belangrijke rol in de variatie van verbindingssterkten tussen de zenuwcellen (de [[synaptische plasticiteit]]) en de groei van kleine stekeltjes op de vertakkingen van zenuwcellen (de [[Dendritische spine|dendritische spines]]). Beide hebben een belangrijke rol in het vermogen tot leren en het geheugen. Reeline is ook belangrijk in de migratie van primitieve zenuwcellen of [[Neuroblast|neuroblasten]].<ref name="Niu S 2004" /><ref name=":3" /> | |||
Reeline wordt afgescheiden door speciale [[Zenuwcel|zenuwcellen]], de [[Cajal-retziuscel|Cajal-Retziuscellen]] in de zich ontwikkelende hersenschors.<ref name=":4">{{Citeer tijdschrift |achternaam=Causeret |voornaam=Frédéric |titel=The multiple facets of Cajal-Retzius neurons |url=http://dx.doi.org/10.1242/dev.199409 |jaargang=148 |tijdschrift=Development |datum=2021-05-28 |nummer=11 |doi=10.1242/dev.199409 |issn=0950-1991 |last2=Moreau |first2=Matthieu X. |last3=Pierani |first3=Alessandra |last4=Blanquie |first4=Oriane}}</ref> Het eiwit moet worden afgegeven in de [[extracellulaire matrix]], het netwerk van verschillende eiwitten dat tussen de cellen is gelegen. Hier vervult reeline haar biologische rol en functie als [[enzym]] dat als zodanig de interacties tussen de verschillende cellen beïnvloedt.<ref name=":2" /> De verwerking ervan in kleinere fragmenten reguleren aspecten van het signaal. Reeline zou aantrekkingskracht uit kunnen oefenen op migrerende cellen of zou juist een soort 'loslaten en stop'-signaal kunnen zijn voor cellen die aan het eind van hun migratie gekomen zijn.<ref>{{Citeer tijdschrift |achternaam=Jossin |voornaam=Yves |titel=Reelin Functions, Mechanisms of Action and Signaling Pathways During Brain Development and Maturation |url=https://www.mdpi.com/2218-273X/10/6/964 |jaargang=10 |tijdschrift=Biomolecules |datum=2020-06 |taal=en |nummer=6 |doi=10.3390/biom10060964 |issn=2218-273X |pagina's=964}}</ref> Reeline blijft ook na de ontwikkeling van het embryo van belang; het wordt bij de mens bijvoorbeeld ook in de hersenen van volwassenen gevonden waar het een rol bij het leervermogen en de werking van het geheugen speelt. Het eiwit wordt daarnaast aangetroffen in andere lichaamsweefsels zoals de [[lever]] en het [[Oog (anatomie)|oog]].<ref>{{Citeer web |url=https://www.proteinatlas.org/ENSG00000189056-RELN/tissue |titel=Tissue expression of RELN - Summary - The Human Protein Atlas |bezochtdatum=2023-12-22 |werk=www.proteinatlas.org}}</ref> | |||
== | == Structuur == | ||
[[Bestand:Schema of the Reelin protein vertical en.png|thumb|100px|Schematische weergave van de structuur van reeline.|links]] | |||
Reeline wordt [[Genetische code|gecodeerd]] door het RELN-gen, waarvan in 1994 werd vastgesteld aan welk chromosoom het gekoppeld is. Het eiwit bestaat uit een keten van 3461 [[aminozuur|aminozuren]] met een [[moleculaire massa]] van 388 [[Atomaire massa-eenheid|kDa]]. Deze keten bestaat in zijn [[Primaire structuur (eiwitten)|primaire structuur]] uit twaalf blokken aminozuren. Het eerste blok is een [[signaalpeptide]], in het schema hiernaast weergegeven met "S". Het volgende blok (in het schema hiernaast in paars met "SP" weergegeven) is vergelijkbaar met spondin 1-proteïne, een eiwit dat is betrokken bij het leiden van [[Axon|axons]]. De structuur van het derde blok, hiernaast aangegeven in rood, met "H", is specifiek van reeline. | |||
Het grootste stuk bestaat uit een herhaling van 8 [[polymeer|ketens]], de zogeheten ''reelin repeats'' ("reelineherhalingen", hier in geel aangegeven). In hun midden hebben deze herhaalde ketens een klein [[peptidehormoon]] (aangegeven met een blauwe lijn), waardoor elke herhaalde keten uit twee subketens (''A'' en ''B'') bestaat. Ondanks deze onderbreking maken de subdomeinen rechtstreeks contact met elkaar, waardoor ze als geheel een compacte structuur vormen.<ref name="reelinstructure2006japan">{{Cite journal |author=Nogi T, Yasui N, Hattori M, Iwasaki K, Takagi J |title=Structure of a signaling-competent reelin fragment revealed by X-ray crystallography and electron tomography |journal=Embo J. |volume=25 |issue=15 |pages=3675–83 |year=2006 |month=augustus |pmid=16858396 |pmc=1538547 |doi=10.1038/sj.emboj.7601240}}</ref> | |||
Het laatste gedeelte omvat een zeer kort en [[base (scheikunde)|basisch]] C-terminaal gebied (CTR, in het schema weergegeven als "+"). Bij bijna alle onderzochte [[Gewervelden|gewervelde dieren]] (behalve [[vissen (dieren)|vis]]sen) kwam alleen dit laatste deel van de aminozuurketen voor 100% overeen, waarmee dit dus het meest conservatieve deel van reeline is. | |||
Het RELN-gen, dat zich bij mensen op [[chromosoom 7]] op de [[locus (biologie)|locus]] 7q22 bevindt,<ref>[https://www.genetests.org/genes/?gene=RELN RELN], genetests.org</ref> is in veel gewervelde soorten geconserveerd, waaronder de mens. De aminozuur- en [[Nucleotidesequentie|nucleotidesequenties]] van muis en mens zijn respectievelijk 94,2% en 87,2% identiek.<ref>{{Citeer tijdschrift |achternaam=DeSilva |voornaam=U. |titel=The human reelin gene: isolation, sequencing, and mapping on chromosome 7 |url=https://pubmed.ncbi.nlm.nih.gov/9049633/ |jaargang=7 |tijdschrift=Genome Research |datum=1997-02 |nummer=2 |doi=10.1101/gr.7.2.157 |archiefurl=https://web.archive.org/web/20180723021040id_/https://genome.cshlp.org/content/7/2/157.full.pdf |issn=1088-9051 |pmid=9049633 |pagina's=157–164 |last2=D'Arcangelo |first2=G. |last3=Braden |first3=V. V. |last4=Chen |first4=J. |last5=Miao |first5=G. G.}}</ref><ref name=":0" />{{Clearright}} | |||
== Ontdekking == | |||
[[Bestand:Reeler 100kbps.ogv|thumb|left|Video: de "reeler-muis" werd voor het eerst beschreven in 1951 door [[D.S.Falconer]]. Later bleek dat deze muizen geen reeline hadden.]] | |||
[[Bestand:Reeler lamination.png|thumb|Doorsnede van de hersenen van een reeler-muis (rechts) vergeleken met die van een gewone muis (links).]] | |||
De | === Experimenten met muizen === | ||
De ontwikkeling van het centrale zenuwstelsel op [[molecuul|moleculair]] niveau wordt bestudeerd aan de hand van mutaties bij muizen. In 1951 ontdekte [[Douglas Scott Falconer]] dat een groep muizen die werd gehouden door [[Charlotte Auerbach]] een abnormaal wankelende manier van lopen vertoonde. Dit bleek het gevolg van een verstoorde ontwikkeling van hun centrale zenuwstelsel. Deze zogeheten ''reelermouse'' vertoonde de afwijking als gevolg van een mutatie van het RELN-gen. Deze afwijking was [[homozygoot]], dat wil zeggen dat beide kopieën ofwel [[Allel|allelen]] van het gen ontbraken. Deze muizen hadden geen expressie van wat reeline genoemd werd, naar het [[fenotype]] en het gedrag van deze muizen die 'wankelden' (in het Engelse betekent ''to reel'' 'wankelen').<ref>{{Citeer tijdschrift |achternaam=Falconer |voornaam=D. S. |titel=Two new mutants, ‘trembler’ and ‘reeler’, with neurological actions in the house mouse (Mus musculus L.) |url=http://dx.doi.org/10.1007/bf02996215 |jaargang=50 |tijdschrift=Journal of Genetics |datum=1951-01 |nummer=2 |doi=10.1007/bf02996215 |archiefurl=https://www.ias.ac.in/article/fulltext/jgen/050/02/0192-0205 |issn=0022-1333 |pagina's=192–205}}</ref> | |||
Muizen met een [[heterozygoot|heterozygote]] mutatie van het RELN-gen daarentegen (die een mutatie in slechts één van de twee allelen bezitten) vertonen weinig [[neuroanatomie|neuroanatomische]] afwijkingen ten opzichte van muizen met een homozygote mutatie van dit gen. De hoeveelheid reeline is daarom waarschijnlijk gehalveerd. Om die reden zijn ze interessant als model bij het onderzoek naar psychosen; bij post-mortem onderzoek op psychotische patiënten bleek namelijk dat er in de hersenen sprake van een [[downregulatie]] van het gen van 50%.<ref>http://www.sciencedirect.com/science/article/pii/S0149763406000388</ref> | |||
Nieuw [[histopathologie|histopathologisch]] onderzoek in de jaren '60 wees uit dat de [[kleine hersenen]] bij dit soort muizen veel kleiner waren dan gewoonlijk, terwijl bovendien op verschillende plekken in het brein de laminaire organisatie anders was. In de jaren '70 werd ook ontdekt dat in een deel van de [[neocortex]] van deze muizen de rangschikking van de diverse celtypen en weefsels anders was dan gewoonlijk; in grote lijnen was de volgorde van cellagen omgekeerd, terwijl anderzijds de [[celdifferentiatie]] normaal leek te verlopen. Op grond hiervan verschoof de aandacht naar de specifieke fysieke eigenschappen van de zogeheten ''reeler''-mutant.<ref>{{en}}Caviness VS (december 1976). "Patterns of cell and fiber distribution in the neocortex of the reeler mutant mouse". J. Comp. Neurol. 170 (4): 435–47. doi:10.1002/cne.901700404. {{PMID|1002868}}.</ref> | |||
=== Identificatie van het reeline-gen === | |||
Reeline werd in 1995 ontdekt in twee muizenstammen, waarvan één spontaan ontstaan was en de ander [[Transgeen organisme|transgeen]] was verkregen. De spontane ''reeler''-mutant was al langer bekend en bewoog zich zoals al bekend met de wankelende gang. Dankzij de transgene muizen kon het gen [[Klonen (biologie)|gekloond]] worden en men vond een grote [[Deletie (genetica)|deletie]] die verklaarde waarom er geen [[Transcriptie (biologie)|transcriptie]] van het gen plaatsvond. De ''reeler'' mutant is daarna ook ontdekt in verschillende rattenstammen en uiteindelijk is het reeline-gen ook in de mens ontdekt en gekloond.<ref>{{Citeer tijdschrift |achternaam=D'Arcangelo |voornaam=Gabriella |titel=Reelin in the Years: Controlling Neuronal Migration and Maturation in the Mammalian Brain |url=https://www.hindawi.com/journals/aneu/2014/597395/ |jaargang=2014 |tijdschrift=Advances in Neuroscience |datum=2014-01-05 |taal=en |doi=10.1155/2014/597395 |issn=2356-6787 |pagina's=e597395}}</ref> | |||
De volgende stap was het leggen van allerlei verbanden tussen de afwezigheid van transcriptie van reeline en allerlei complexe aandoeningen, zoals autisme en de ziekte van Alzheimer. In de eerste jaren van de 21e eeuw werd er steeds meer bekend over de structuur en functie van het eiwit. | |||
== | == Expressie == | ||
{{Zie ook|zie ook [[Genexpressie]]}} | |||
[[Bestand:2e26.png|thumb|Kristallografische structuur van reeline. Bron: Yasui et al., 2007.<ref name="pmid17548821">{{Cite journal |author=Yasui N, Nogi T, Kitao T, Nakano Y, Hattori M, Takagi J |title=Structure of a receptor-binding fragment of reelin and mutational analysis reveal a recognition mechanism similar to endocytic receptors |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=104 |issue=24 |pages=9988–93 |year=2007 |month=juni |pmid=17548821 |pmc=1891246 |doi=10.1073/pnas.0700438104}}</ref>]] | |||
[[Bestand:Cajal-Retzius cell drawing by Cajal 1891.gif|thumb|Cajal-Retziuscellen zoals getekend door Cajal in 1891. De ontwikkeling van het moderne brein wordt gekenmerkt door de vorming van een afzonderlijke laag cellen waarin expressie van reeline plaatsvindt.]] | |||
[[Bestand:Differential reelin levels in the cortex of adult high and low LG rats.gif|thumb|330px|Vermeerderde reeline-expressie in de cortex van jonge "High LG"-ratten. Een afbeelding van Smit-Rigter et al., 2009<ref>{{en}}http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0005167</ref>]] | |||
Reeline is bijzonder belangrijk gedurende de prenatale ontwikkeling van het zenuwstelsel en de expressie ervan is het hoogst gedurende de embryonale fase. | |||
[[Cajal-retziuscel|Cajal-Retziuscellen]], zenuwcellen met lange horizontale axonen, scheiden reeline af in combinatie met het eiwitproduct van het zogeheten [[HAR1]](''Human accelerated regions'')-gen. Dit laatste gen heeft bij de mens een zeer sterke evolutionaire verandering doorlopen ten opzichte van de chimpansee. Dit gen wordt bij menselijke embryo's tussen de 7e en de 19e week van zwangerschap afgeschreven in de zich ontwikkelende neocortex. Reeline en HAR1 samen dragen bij aan de vorming van de typische zes-lagen structuur van de neocortex.<ref>{{en}}Pollard KS, Salama SR, Lambert N, et al. (september 2006). "An RNA gene expressed during cortical development evolved rapidly in humans". Nature 443 (7108): 167–72. doi:10.1038/nature05113. {{PMID|16915236}}.</ref> | |||
=== Belangrijke expressiegebieden === | |||
Reeline wordt niet uitgescheiden via de [[synaptische blaasjes]] zoals in het geval van [[neurotransmitters]], maar verlaat de cel met [[exocytose]] door de blaasjes van het [[golgi-apparaat]]. De snelheid waarmee het eiwit vrijkomt is dus niet afhankelijk van [[depolarisatie (biologie)|depolarisatie]], maar wordt uitsluitend bepaald door de snelheid waarmee de [[eiwitsynthese|synthese]] plaatsvindt.<ref>{{Citeer tijdschrift |achternaam=Lacor |voornaam=Pascale N. |titel=Reelin secretion from glutamatergic neurons in culture is independent from neurotransmitter regulation |url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC16278/ |jaargang=97 |tijdschrift=Proceedings of the National Academy of Sciences of the United States of America |datum=2000-03-28 |nummer=7 |issn=0027-8424 |pmid=10725375 |pagina's=3556–3561 |last2=Grayson |first2=Dennis R. |last3=Auta |first3=James |last4=Sugaya |first4=Ikuko |last5=Costa |first5=Erminio}}</ref> Dit geldt ook voor de afscheiding van andere eiwitten in de extracellulaire matrix. | |||
Aan het begin van de ontwikkeling van de [[hersenen]] wordt reeline het eerst aangetroffen in de uitwendige granulaire laag en in delen van het tectum ([[mesencephalon]]), de [[hypothalamus]] en in de [[wervelkolom]]. Vervolgens vindt migratie naar de inwendige lagen plaats. Onderzoek bij de mens van embryo's en pasgeborenen toonde aan dat de cellen waarin expressie van reeline plaatsvindt voor en kort na de geboorte vooral aangetroffen worden in de marginale zone van de hersenschors en de tijdelijk aanwezige subpiale granulaire laag (SGL). Na 11 weken zwangerschap bleek in de marginale zone een laag reeline-positieve mono- of bipolaire horizontale Cajal-Retziuscellen aanwezig. Na de 14e week vormde zich in de SGL een tweede laag reeline-positieve cellen.<ref name="MEYER1998">{{en}}Meyer G, Goffinet AM (juli 1998). "Prenatal development of reelin-immunoreactive neurons in the human neocortex". J. Comp. Neurol. 397 (1): 29–40. doi:10.1002/(SICI)1096-9861(19980720)397:1<29::AID-CNE3>3.3.CO;2-7. {{PMID|9671277}}.</ref> Het eiwit wordt in de prenatale fase afgescheiden door de in de [[Cortex cerebelli|cortex]] en de [[Hippocampus (hersenen)|hippocampus]] aanwezige Cajal-, Retzius- en Cajal-Retziuscellen. Deze laatste verdwijnen bijna en sterven grotendeels af na 27 weken, nadat de cortex gevormd is.<ref name=":4" /> | |||
Bij [[gewervelden]] werd in de [[Grote hersenen|telencephalon]] reeline aangetroffen. Het expressiepatroon blijkt te variëren bij verschillende diersoorten; bij [[zebravis]]sen bijvoorbeeld – die geen Cajal-Retziuscellen hebben – werd het eiwit door zenuwcellen in het hele [[dorsaal|dorsale]] gedeelte van het [[pallium (neuroanatomie)|pallium]] geëxprimeerd.<ref>{{en}}Costagli A, Kapsimali M, Wilson SW, Mione M (augustus 2002). "Conserved and divergent patterns of Reelin expression in the zebrafish central nervous system". J. Comp. Neurol. 450 (1): 73–93. doi:10.1002/cne.10292. {{PMID|12124768}}.</ref> Ook in de hersenschors van [[schubreptielen]] bleek de verdeling van de gebieden met reeline-expressie weer anders.<ref>{{en}}Pérez-García CG, González-Delgado FJ, Suárez-Solá ML, et al. (januari 2001). "Reelin-immunoreactive neurons in the adult vertebrate pallium". J. Chem. Neuroanat. 21 (1): 41–51. doi:10.1016/S0891-0618(00)00104-6. {{PMID|11173219}}.</ref> In de cortex en hippocampus van volwassen ratten vindt de expressie hoofdzakelijk plaats in zenuwcellen, waar synthese van [[gamma-aminoboterzuur]] (GABA) plaatsvindt en door de weinige overgebleven Cajal-Retziuscellen.<ref>{{en}}Pesold C, Impagnatiello F, Pisu MG, et al. (maart 1998). "Reelin is preferentially expressed in neurons synthesizing gamma-aminobutyric acid in cortex and hippocampus of adult rats". Proc. Natl. Acad. Sci. U.S.A. 95 (6): 3221–6. doi:10.1073/pnas.95.6.3221. {{PMID|9501244}}.</ref> | |||
' | Behalve in de hersenen wordt reeline ook aangetroffen in het bloed (met name bij volwassen organismen), in een deel van de [[pars intermedia]] in de [[hypofyse]] en in de [[bijnier]]en. De voornaamste bron van reeline buiten de hersenen zijn de zogenaamde stercellen van de [[lever]].<ref>{{Citeer tijdschrift |achternaam=Alexander |voornaam=Anna |titel=Reelin through the years: From brain development to inflammation |url=http://dx.doi.org/10.1016/j.celrep.2023.112669 |jaargang=42 |tijdschrift=Cell Reports |datum=2023-06 |nummer=6 |doi=10.1016/j.celrep.2023.112669 |issn=2211-1247 |pagina's=112669 |last2=Herz |first2=Joachim |last3=Calvier |first3=Laurent}}</ref> De concentratie van reeline in de lever is verhoogd bij een leverbeschadiging en keert na genezing terug op normaal niveau. Ook in de ogen wordt reeline afgescheiden, in het [[netvlies]] en het [[hoornvlies]]. Uit proeven met muizen blijkt dat de meeste expressie ervan plaatsvindt tijdens de ontwikkeling van het netvlies; net als in de lever neemt de expressie ook hier toe na verwondingen. Ten slotte wordt het eiwit ook nog afgescheiden door de [[odontoblast]]en aan de randen van het [[tandpulpa]]; zowel gedurende het hele proces van tandontwikkeling als in volwassen tanden wordt op deze plekken reeline aangetroffen.<ref>{{Citeer tijdschrift |achternaam=Maurin |voornaam=Jean-Christophe |titel=Expression and localization of reelin in human odontoblasts |url=https://www.sciencedirect.com/science/article/pii/S0945053X04000812 |jaargang=23 |tijdschrift=Matrix Biology |datum=2004-08-01 |nummer=5 |doi=10.1016/j.matbio.2004.06.005 |issn=0945-053X |pagina's=277–285 |last2=Couble |first2=Marie-Lise |last3=Didier-Bazes |first3=Marianne |last4=Brisson |first4=Christine |last5=Magloire |first5=Henry}}</ref> | ||
===Andere factoren die de expressie beïnvloeden=== | === Andere factoren die de expressie beïnvloeden === | ||
Een post-mortem studie wees uit dat in de neocortex van personen die de [[puberteit]] al hadden doorlopen de [[methylering]] van het RELN-gen veel hoger was dan bij personen die nog niet in de puberteit waren. Methylering van DNA of histonen duidt meestal op inactivering van genen. Dit zou betekenen dat de expressie van het RELN-gen na de puberteit wordt onderdrukt. | |||
Bij jonge ratten bleek de moederlijke zorg (''licking and grooming''; LG) van invloed te zijn op de [[Dendritische cel|dendritische]] structuur en functie van neuronen van de [[somatosensibele schors]] en op het [[transcriptoom]] in de hippocampus, en bijgevolg ook op de expressie van allerlei genen in deze gebieden, waaronder het reeline-gen. Het feit dat dit effect zowel kan worden gestimuleerd als afgeremd, wijst erop dat het ook nog omkeerbaar is nadat de ratten eenmaal geboren zijn.<ref>http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1413873/?tool=pmcentrez</ref><ref>Smit-Rigter LA, Champagne DL, van Hooft JA (2009). "Lifelong impact of variations in maternal care on dendritic structure and function of cortical layer 2/3 pyramidal neurons in rat offspring". PLoS ONE 4 (4): e5167. doi:10.1371/journal.pone.0005167. {{PMID|19357777}}. PMC 2663818. http://dx.plos.org/10.1371/journal.pone.0005167.</ref> Als gevolg van herhaaldelijke blootstelling aan [[Corticosteroïden|corticosteron]] neemt het aantal reeline-positieve cellen en daarmee de expressie van reeline in de hippocampus van ratten af. Dit gegeven zou van belang kunnen zijn voor depressies waar [[corticosteroïden]] een hypothetische rol in hebben.<ref>{{Citeer tijdschrift |achternaam=Lussier |voornaam=April L. |titel=Repeated exposure to corticosterone, but not restraint, decreases the number of reelin-positive cells in the adult rat hippocampus |url=https://www.sciencedirect.com/science/article/pii/S0304394009006995 |jaargang=460 |tijdschrift=Neuroscience Letters |datum=2009-08-28 |nummer=2 |doi=10.1016/j.neulet.2009.05.050 |issn=0304-3940 |pagina's=170–174 |last2=Caruncho |first2=Hector J. |last3=Kalynchuk |first3=Lisa E.}}</ref> | |||
== | |||
== Mechanisme == | == Mechanisme == | ||
=== Receptoren === | |||
[[Bestand:Rostral migratory stream mouse cropped.jpg|thumb|280px|Neuroblasten binnen de [[rostrale migratoire stroom]] (RMS) worden waarschijnlijk bijeen gehouden dankzij [[thrombospondine-1]]-deeltjes die zich binden aan de receptoren ApoER en VLDLR.<ref>^ {{en}}Lennington JB, Yang Z, Conover JC (november 2003). "Neural stem cells and the regulation of adult neurogenesis". Reprod. Biol. Endocrinol. 1: 99. doi:10.1186/1477-7827-1-99. {{PMID|14614786}}. PMC: 293430. http://www.rbej.com/content/1//99.</ref> Eenmaal aangekomen op hun plaats van bestemming worden ze door de reeline uit elkaar gedreven en gaan de cellen ieder hun eigen weg.]] | |||
In 1998 werden de twee [[receptor (biochemie)|receptoren]] van reeline ontdekt: de [[lipoproteïne]]-receptoren [[ApoER2]] en [[VLDLR]]. Ook toen werd het eerste verband gelegd tussen deze receptoren en het ontstaan van de ziekte van Alzheimer. Nader onderzoek wees uit dat de hersenschorslagen van zogeheten ''double knockout''-muizen - die zowel ApoEr2 als VLDLR misten - dezelfde gebreken vertoonden als die welke bij reelermuizen werden aangetroffen. Zo werd duidelijk dat deze receptoren een belangrijke rol spelen bij de [[signaaltransductie]] van het reelinesignaal.<ref name=":1" /> | |||
Vervolgens bleek ook het [[fenotype]] van muizen waarbij het gen Dab1 (Disabled-1) was verstoord (''yotari'' en ''scrambler'') veel overeenkomsten te vertonen met dat van reelermuizen.<ref>{{en}}Sheldon M, Rice DS, D'Arcangelo G, et al. (oktober 1997). "Scrambler and yotari disrupt the disabled gene and produce a reeler-like phenotype in mice". Nature 389 (6652): 730–3. doi:10.1038/39601. {{PMID|9338784}}.</ref><ref name="cingulate.ibms.sinica.edu.tw">http://www.cingulate.ibms.sinica.edu.tw - GABA in autism</ref><ref name=":1">{{Citeer tijdschrift |achternaam=Fatemi |voornaam=S H |titel=Reelin glycoprotein: structure, biology and roles in health and disease |url=http://dx.doi.org/10.1038/sj.mp.4001613 |jaargang=10 |tijdschrift=Molecular Psychiatry |datum=2004-12-07 |nummer=3 |doi=10.1038/sj.mp.4001613 |archiefurl=https://books.google.nl/books?id=CG0t08bK9SYC&pg=PA3&lpg=PA3&dq=mouse+reelin+%22double+knockout%22+cortical+layer&source=bl&ots=AUjpLikV5w&sig=8BN8pMW86yt3BCtQ_1p6Iyq0Ic8&hl=nl&sa=X&ei=Hq4eT8faGMWi-ga45_kt&ved=0CFEQ6AEwAw#v=onepage&q=double%20knockout&f=false |issn=1359-4184 |pagina's=251–257}}</ref> | |||
Reeline is een [[ligand]] die hoofdzakelijk bindt aan VLDLR en ApoER2.<ref>{{Citeer tijdschrift |achternaam=D'Arcangelo |voornaam=Gabriella |titel=Reelin Is a Ligand for Lipoprotein Receptors |url=https://doi.org/10.1016/S0896-6273(00)80860-0 |jaargang=24 |tijdschrift=Neuron |datum=1999-10 |nummer=2 |doi=10.1016/s0896-6273(00)80860-0 |issn=0896-6273 |pagina's=471–479 |last2=Homayouni |first2=Ramin |last3=Keshvara |first3=Lakhu |last4=Rice |first4=Dennis S |last5=Sheldon |first5=Michael}}</ref> ApoER2 (Apolipoprotein E Receptor 2) is een molecuul dat zich aan het oppervlak van cellen bevindt en na binding met reeline [[signaaltransductie]] tot gevolg heeft in de cellen.<ref>{{en}}Andersen, Olav M; Benhayon David, Curran Tom, Willnow Thomas E (Aug. 2003). "Differential binding of ligands to the apolipoprotein E receptor 2". Biochemistry (United States) 42 (31): 9355-64. doi:10.1021/bi034475p. ISSN 0006-2960. {{PMID|12899622}}.</ref> Dankzij deze bindingen worden clusters gevormd, die op hun beurt een cruciale rol spelen bij het verloop van de [[signaaltransductie]]. De intracellulaire adaptor [[DAB1]] kan hierdoor op zijn beurt gaan dimeriseren of oligomeriseren. Aangetoond is dat soortgelijke clusters zelfs bij afwezigheid van reeline een dergelijke signaalketen kunnen activeren.<ref>{{en}}Strasser V, Fasching D, Hauser C, et al. (februari 2004). "Receptor clustering is involved in Reelin signaling". Molecular and cellular biology 24 (3): 1378–86. doi:10.1128/MCB.24.3.1378-1386.2004. {{PMID|14729980}}. PMC 321426. http://mcb.asm.org/cgi/pmidlookup?view=long&pmid=14729980.</ref> | |||
De twee hoofdreceptoren van reeline lijken in de neuronale migratie niet helemaal dezelfde rol te spelen. Zo lijkt VLDLR hoofdzakelijk het stopsignaal voor de [[celmigratie]] door te geven, terwijl ApoER2 verantwoordelijk is voor het stimuleren van de migratie van neocorticale zenuwcellen.<ref>{{en}}Hack I, Hellwig S, Junghans D, Brunne B, Bock HH, Zhao S, Frotscher M (2007). "Divergent roles of ApoER2 and Vldlr in the migration of cortical neurons". Development 134 (21): 3883–91. doi:10.1242/dev.005447. {{PMID|17913789}}.</ref> | |||
Interactie van het gen van ApoER2 met [[NMDA-receptor]]en vormt de basis voor vergroting van de [[langetermijnpotentiëring]] (LTP) dankzij reeline.<ref>{{en}}Beffert U, Weeber EJ, Durudas A, et al. (augustus 2005). "Modulation of synaptic plasticity and memory by Reelin involves differential splicing of the lipoprotein receptor Apoer2" (PDF). Neuron 47 (4): 567–79. doi:10.1016/j.neuron.2005.07.007. {{PMID|16102539}}. http://jax.herzlab.org/Course2006/presentations/Beffert2005.pdf.</ref> | |||
=== Fosforylering van DAB1 === | |||
Reelinemoleculen vormen een [[eiwitcomplex]], het zogeheten [[Zwavelbrug|disulfide gebonden]] [[Dimeer|homodimeer]]. Wanneer deze homodimeer niet wordt gevormd, is een goede tyrosinefosforylering van DAB1, welke nodig is voor transductie van het reelinesignaal, [[in vitro]] gedoemd te mislukken.<ref>{{en}}Utsunomiya-Tate N, Kubo K, Tate S, et al. (augustus 2000). "Reelin molecules assemble together to form a large protein complex, which is inhibited by the function-blocking CR-50 antibody". Proc. Natl. Acad. Sci. U.S.A. 97 (17): 9729–34. doi:10.1073/pnas.160272497. {{PMID|10920200}}.</ref><ref>Kubo K, Mikoshiba K, Nakajima K (augustus 2002). "Secreted Reelin molecules form homodimers". Neurosci. Res. 43 (4): 381–8. doi:10.1016/S0168-0102(02)00068-8. {{PMID|12135781}}.</ref> | |||
De intracellulaire adaptor DAB1 gaat met VLDLR en ApoER2 een verbinding aan waarbij het een rol speelt in de transmissie van reelinesignalen via deze receptoren.<ref>{{Citeer tijdschrift |achternaam=Howell |voornaam=B. W. |titel=Mouse disabled (mDab1): a Src binding protein implicated in neuronal development |url=https://pubmed.ncbi.nlm.nih.gov/9009273/ |jaargang=16 |tijdschrift=The EMBO journal |datum=1997-01-02 |nummer=1 |doi=10.1093/emboj/16.1.121 |issn=0261-4189 |pmid=9009273 |pmc=1169619 |pagina's=121–132 |last2=Gertler |first2=F. B. |last3=Cooper |first3=J. A.}}</ref> | |||
De | |||
=== | === Demethylering === | ||
Bij ratten neemt als gevolg van [[demethylering]] van het RELN-gen, de expressie van reeline in de hippocampus sterk toe wanneer er iets in het geheugen moet worden opgeslagen, bijvoorbeeld bij angst.<ref>{{en}}Miller CA, Sweatt JD (maart 2007). "Covalent modification of DNA regulates memory formation". Neuron 53 (6): 857–69. doi:10.1016/j.neuron.2007.02.022. {{PMID|17359920}}.</ref> | |||
=== Splitsing === | |||
Reeline kan op twee plekken worden gesplitst: na het tweede en het zesde domein, tussen de herhalingen 2/3 en 6/7. Hierdoor ontstaan 3 fragmenten. Deze splitsing leidt echter niet tot een verminderde eiwitactiviteit, omdat de delen die ontstaan uit de centrale fragmenten (de herhaalde aminozuurreeksen 3-6) zich binden aan de lipoproteïnereceptoren, waar ze [[fosforylering]] van het DAB1-gen in de zich ontwikkelende zenuwcellen op gang brengen en zo de rol van reeline in de zich ontwikkelende [[hersenschors]] imiteren.<ref>{{en}}Jossin Y, Ignatova N, Hiesberger T, Herz J, Lambert de Rouvroit C, Goffinet AM (januari 2004). "The central fragment of Reelin, generated by proteolytic processing in vivo, is critical to its function during cortical plate development". J. Neurosci. 24 (2): 514–21. doi:10.1523/JNEUROSCI.3408-03.2004. {{PMID|14724251}}</ref> | |||
=== Andere interacties === | |||
Reeline heeft behalve met zijn receptoren en DAB-1 vele interacties met andere proteïnen. Bijvoorbeeld met [[Integrine|integrinen]] die zich tijdens de vorming van de hersenschors binden aan de [[N-terminus]] van reeline, waardoor de neurale migratie wordt geremd.<ref>{{Citeer web |url=https://www.rndsystems.com/target/reelin |titel=Reelin: Products |voornaam=Biotechne |auteur=R&D systems |bezochtdatum=2023-11-21 |taal=en}}</ref> Ook DAB1 heeft interacties en is doelwit van fosforylering waardoor het geactiveerd wordt.<ref>{{Citeer tijdschrift |achternaam=Kobayashi |voornaam=Shunsuke |titel=A cdc2-related kinase PSSALRE/cdk5 is homologous with the 30 kDa subunit of tau protein kinase II, a proline-directed protein kinase associated with microtubule |url=https://www.sciencedirect.com/science/article/pii/0014579393807238 |jaargang=335 |tijdschrift=FEBS Letters |datum=1993-12-06 |nummer=2 |doi=10.1016/0014-5793(93)80723-8 |issn=0014-5793 |pagina's=171–175 |last2=Ishiguro |first2=Koichi |last3=Omori |first3=Akira |last4=Takamatsu |first4=Masako |last5=Arioka |first5=Manabu}}</ref> | |||
Reeline is een serineprotease en kan daarmee bepaalde peptideverbindingen verbreken. Hierdoor kunnen met name het verloop van de neuronale migratie en de adhesie van cellen aan [[fibronectine]] negatief worden beïnvloed.<ref name=":2">{{en}}Quattrocchi CC, Wannenes F, Persico AM, Ciafré SA, D'Arcangelo G, Farace MG, Keller F. (januari 2002). "Reelin is a serine protease of the extracellular matrix". J. Biol. Chem. 277 (1): 303–9. doi:10.1074/jbc.M106996200. {{PMID|11689558}}.</ref> | |||
Reeline | |||
== Functies == | |||
De precieze functie van reeline wordt vooral bepaald door het tijdstip waarop de expressie ervan plaatsheeft en de plaats in het lichaam waar het een rol speelt. De manier waarop het centrale of volledige deel van reeline door embryonale zenuwcellen wordt verwerkt is mogelijk in hoge mate bepalend voor een goed verloop van de signalering en de ontwikkeling van de hersenschors.<ref>name="pmid17442808">{{Cite journal |author=Jossin Y, Gui L, Goffinet AM |title=Processing of Reelin by embryonic neurons is important for function in tissue but not in dissociated cultured neurons |journal=J. Neurosci. |volume=27 |issue=16 |pages=4243–52 |year=2007 |month=april |pmid=17442808 |doi=10.1523/JNEUROSCI.0023-07.2007 |url=}}</ref> | |||
=== Signalering === | |||
[[Bestand:Model of Reelin and Lis1 signaling - journal.pone.0000252.g008.png|thumb|280px|De belangrijkste reeline-signaleringscascade (ApoER2 en VLDLR) en de interactie hiervan met het [[fosfoproteïne]] [[LIS1]]. '''SFK''': [[Kinasen Src-familie]]. '''JIP''': [[MAPK8IP1]].]] | |||
=== | ==== In celmigratie ==== | ||
Het centrale fragment van reeline, waarin de delen drie tot zes zitten, is noodzakelijk en voldoende om de functies van reeline uit te voeren. Het is net zo efficiënt als reeline van volledige lengte bij het binden aan zijn twee receptoren VLDLR en ApoER2, bij het induceren van Dab1-fosforylering en van de vorming van een goed georganiseerde corticale plaat in een organotypisch hersenschijfje dat geen reeline bevat. De [[proteolyse]] ofwel de splitsing van reeline blokkeert dus niet de functie ervan. Zowel de fragmenten als het hele reeline-eiwit worden na binding met de receptoren geïnternaliseerd en afgebroken. Het blokkeren van de splitsing van reeline voorkomt ook de fosforylering van de interne adapter Dab 1 waarbij er een afwijking ontstaat in de corticale plaat. Het is mogelijk dat de uiteinden van het reeline-eiwit in de extracellulaire matrix blijven zitten en dat het proces van splitsen van reeline nodig is om het middelste fragment de receptoren van reeline te laten bereiken.<ref name=":0">{{Citeer tijdschrift |achternaam=Jossin |voornaam=Yves |titel=Reelin Functions, Mechanisms of Action and Signaling Pathways During Brain Development and Maturation |url=https://www.mdpi.com/2218-273X/10/6/964 |jaargang=10 |tijdschrift=Biomolecules |datum=2020-06 |taal=en |nummer=6 |doi=10.3390/biom10060964 |issn=2218-273X |pagina's=964}}</ref> | |||
De signaleringsroute van reeline omvat de specifieke VLDLR en ApoER2-receptoren, de intracellulaire adapter Dab1 en de twee [[tyrosinekinasen|tyrosine kinasen]] Src en Fyn. Reeline bindt de twee receptoren die internaliseren en clusteren tot [[Dimeer|dimeren]] of multimeren. Dit brengt de fosforylering van Dab1 door Src en Fyn teweeg. Het gefosforyleerde Dab 1 induceert [[signaaltransductie]] met verschillende uitkomsten. De daaropvolgende [[Ubiquitine|ubiquitinatie]] van Dab 1 betekent een neerwaarts regulatie door afbraak van dit eiwit.<ref name=":0" /> | |||
==== In maturatie ==== | |||
Na de geboorte verdwijnen bij muizen en de mens langzaamaan de Cajal–Retziuscellen. Na de geboorte wordt reelin in volwassen muizen door verschillende soorten neuronen geproduceerd in de cortex en de hippocampus. De productie van reeline is dan vooral belangrijk voor de ontwikkeling van de [[Dendriet (neurologie)|dendrieten]], de [[dendritische spine]] en de [[Synaps|synapsen]].<ref name=":0" /> | |||
=== Herstel van organen en weefsels === | |||
Bij muizen bleek de expressie van reeline tijdelijk hoger bij verwondingen aan de lever, in cellen in de beschadigde gebieden. Nadat de verwondingen waren genezen keerde de expressie terug tot het normale niveau.<ref name="Kobold D 2002">Kobold D, Grundmann A, Piscaglia F, et al. (mei 2002). "Expression of reelin in hepatic stellate cells and during hepatic tissue repair: a novel marker for the differentiation of HSC from other liver myofibroblasts". J. Hepatol. 36 (5): 607–13. doi:10.1016/S0168-8278(02)00050-8. {{PMID|11983443}}.</ref> Het blijft echter onduidelijk of en in hoeverre reeline-expressie betrokken is bij het herstelproces; bij een andere studie herstelden muizen zonder dit eiwit eveneens volledig.<ref name="Kobold D 2002" /><ref>{{en}}Pulido JS, Sugaya I, Comstock J, Sugaya K (juni 2007). "Reelin expression is upregulated following ocular tissue injury". Graefes Arch. Clin. Exp. Ophthalmol. 245 (6): 889–93. doi:10.1007/s00417-006-0458-4. {{PMID|17120005}}.</ref> | |||
=== Zenuwstelsel === | |||
De rol die reeline speelt bij de groei en ontwikkeling van het [[centraal zenuwstelsel]] is belangrijker en hier is ook meer over bekend. Gedurende de embryonale fase speelt reeline een belangrijke rol bij de vorming hiervan, doordat het in hoge mate bijdraagt aan het aansturen van de [[neuronale migratie]]. Reeline stimuleert daarnaast de ontwikkeling van bepaalde [[dendriet (neurologie)|dendrieten]]<ref name="Niu S 2004">Niu S, Renfro A, Quattrocchi CC, Sheldon M, D'Arcangelo G (januari 2004). "Reelin promotes hippocampal dendrite development through the VLDLR/ApoER2-Dab1 pathway". Neuron 41 (1): 71–84. doi:10.1016/S0896-6273(03)00819-5. {{PMID|14715136}}.</ref><ref name=":3">{{en}}Niu S, Yabut O, D'Arcangelo G (oktober 2008). "The Reelin signaling pathway promotes dendritic spine development in hippocampal neurons". The Journal of neuroscience: the official journal of the Society for Neuroscience 28 (41): 10339–48. doi:10.1523/JNEUROSCI.1917-08.2008. {{PMID|18842893}}. http://www.jneurosci.org/cgi/pmidlookup?view=long&pmid=18842893.</ref> en blijft ook een belangrijke rol spelen nadat de hersenen eenmaal zijn volgroeid; zo regelt reeline in deze fase bijvoorbeeld de [[synaptische plasticiteit]].<ref name="D'Arcangelo G 2005">D'Arcangelo G (augustus 2005). "Apoer2: a reelin receptor to remember". Neuron 47 (4): 471–3. doi:10.1016/j.neuron.2005.08.001. {{PMID|16102527}}.</ref> Daarnaast regelt het de voortgezette migratie van nieuwe [[neuroblast]]en vanaf plekken waar tijdens de volwassenheid [[neurogenese]] plaatsvindt, zoals de [[subventriculaire zone]] en de [[subgranulaire zone]]. | |||
Reeline stimuleert de [[celdifferentiatie|differentiatie]] van [[Voorlopercel|progenitorcel]]len naar radiaire [[Gliacel|gliacellen]] en beïnvloedt de vezeloriëntatie hiervan. Hierdoor worden migrerende neuroblasten aangestuurd.<ref name="Hartfuss E 2003">{{en}}Hartfuss E, Förster E, Bock HH, et al. (oktober 2003). "Reelin signaling directly affects radial glia morphology and biochemical maturation". Development 130 (19): 4597–609. doi:10.1242/dev.00654. {{PMID|12925587}}.</ref> Dankzij deze oriëntatie worden onder meer de laag-specifieke verbindingen tussen de hippocampus en de [[entorinale schors]] door reeline geregeld.<ref>{{en}}A role for Cajal-Retzius cells and reelin in the development of hippocampal connections. Del Río JA, Heimrich B, Borrell V, Förster E, Drakew A, Alcántara S, Nakajima K, Miyata T, Ogawa M, Mikoshiba K, Derer P, Frotscher M, Soriano E. Nature. 1997 Jan 2;385(6611):70-4. {{PMID|8985248}}</ref> | |||
[[Bestand:Reelin induces GFAP and FABP7 via Notch1.jpg|thumb|280px|Reeline stimuleert de progenitorcellen om zich te ontwikkelen tot verschillende radiaire gliacellen, door het in gang zetten van de [[FABP7]]-afscheiding die de [[NOTCH1]]- activeert.]] | |||
[[Bestand:Reelin controls directed growth of radial fibers - journal.pone.0001454.g005 center cropped.jpg|thumb|280px|Reeline stuurt de groeirichting van de radiaire glia. Reeline-exprimerende cellen (rood) in afbeelding C stimuleren de groei van groene gliavezels, terwijl in afbeelding B de rode cellen geen reeline exprimeren, waardoor de radiaire glia onregelmatiger is.]] | |||
[[Bestand:An increase of Reelin-positive cells changes morphology of migrating neurons - journal.pone.0001454.g007.jpg|thumb|280px|Dankzij een toegenomen expressie van reeline verandert de [[morfologie (biologie)|morfologie]] van de migrerende zenuwcellen. In tegenstelling tot de ronde zenuwcellen met korte vertakkingen (C) nemen deze zenuwcellen een bipolaire vorm aan (D). Ook hechten ze zich (E) aan de radiaire glia-vezels die zich uitstrekken in de richting van de cellen die reeline exprimeren.]] | |||
[[Bestand:Schematic illustration of differences in neuronal specification and migration patterns between the mammalian and avian pallium.png|thumb|250px|Gedurende de ontwikkeling van zenuwcellen bij zoogdieren (links) respectievelijk bij vogels (rechts) vertoont de reeline-expressie (roze) niet hetzelfde patroon.<!--<ref name="Nomura T 2008" />-->]] | |||
Ook in volwassen zenuwstelsels blijft reeline een belangrijke rol spelen in de twee meest actieve gebieden waar de neurogenese plaatsvindt: de subventriculaire zone en de [[gyrus dentatus]]. Bij sommige diersoorten migreren de neuroblasten eerst in ketens vanuit de subventriculaire zone als onderdeel van de [[rostrale migratoire stroom]] naar de [[bulbus olfactorius]], waar ze vervolgens door de reeline worden [[dissociatie (scheikunde)|gedissocieerd]] om uiteindelijk als individuele cellen verder te gaan. De migratie van deze individuele cellen verandert daarbij van [[tangentiële migratie|tangentieel]] in [[radiaire migratie|radiair]], terwijl de cellen de radiaire gliavezels gebruiken als "gids". | |||
Volgens onderzoek functioneren de receptoren ApoER2 en VLDLR en hun intracellulaire adapter DAB1 in de postnatale neuronale migratie onafhankelijk van reeline en onder invloed van het eiwit [[thrombospondine-1|Trombospondine-1]].<ref>{{en}}Andrade N, Komnenovic V, Blake SM, et al. (mei 2007). "ApoER2/VLDL receptor and Dab1 in the rostral migratory stream function in postnatal neuronal migration independently of Reelin". Proceedings of the National Academy of Sciences of the United States of America 104 (20): 8508–13. doi:10.1073/pnas.0611391104. {{PMID|17494763}}. PMC: 1895980. http://www.pnas.org/cgi/pmidlookup?view=long&pmid=17494763.</ref><ref>{{en}}Blake SM, Strasser V, Andrade N, et al. (oktober 2008). "Thrombospondin-1 binds to ApoER2 and VLDL receptor and functions in postnatal neuronal migration". The EMBO journal 27: 3069. doi:10.1038/emboj.2008.223. {{PMID|18946489}}</ref> | |||
====Corticogenese==== | In de volgroeide gyrus dentatus fungeert reeline als sturingsmechanisme voor nieuwe neuronen die vanuit de subgranulaire zone in de laag granulecellen belanden.<ref>Frotscher M, Haas CA, Förster E (juni 2003). "Reelin controls granule cell migration in the dentate gyrus by acting on the radial glial scaffold". Cereb. Cortex 13 (6): 634–40. doi:10.1093/cercor/13.6.634. {{PMID|12764039}}.</ref> In de volwassen hersenen draagt het eiwit voornamelijk bij aan het reguleren van de hoeveelheid afgescheiden [[Cortex cerebelli|corticale]] [[piramidecellen]], de vertakking van dendrieten en de [[langetermijnpotentiëring]].<ref name="D'Arcangelo G 2005" /> | ||
==== Corticogenese ==== | |||
Ook bij de ontwikkeling van de hersenschors bij [[zoogdieren]] speelt reeline een zeer belangrijke rol, met name in de allereerste fase waarin de zogeheten "preplaat" wordt opgesplitst in een oppervlakkige marginale zone en een tijdelijke subplaat. Tussen deze twee lagen bewegen zich volgens het "inside out"-principe de neuronale lagen.<ref>{{Citeer web |url=https://www.ntvg.nl/artikelen/ontwikkeling-en-ontwikkelingsstoornissen-van-het-humane-brein-iii-neuronale |titel=Ontwikkeling en ontwikkelingsstoornissen van het humane brein. III. Neuronale migratiestoornissen van de grote hersenen {{!}} NTvG |datum=2001-03-11 |bezochtdatum=2023-11-30 |werk=www.ntvg.nl |taal=nl}}</ref> | |||
Het migreren van pas gevormde zenuwcellen naar de bovenliggende lagen is kenmerkend voor de hersenen van zoogdieren | Het migreren van pas gevormde zenuwcellen naar de bovenliggende lagen is kenmerkend voor de hersenen van zoogdieren; in de zich ontwikkelende hersenschors van reptielen migreren de zenuwcellen net in de omgekeerde richting.<ref>{{en}}http://www3.interscience.wiley.com/journal/109688628/abstract?CRETRY=1&SRETRY=0</ref> Reeline blijkt een sturende rol te hebben in de tangentiële migratie van zowel de [[interneuron]]en naar de corticale plaat als die van de [[pioniersneuron]]en naar de marginale zone.<ref>{{en}}http://www.pnas.org/content/100/21/12468.abstract</ref> Een reelinetekort heeft bij zoogdieren dan ook tot gevolg dat ook de uiteindelijke volgorde van de hersenschorslagen min of meer wordt omgedraaid. | ||
Over de precieze manier waarop reeline de tangentiële migratie en daarmee de uiteindelijke volgorde van de hersenschorslagen beïnvloedt bestaat echter nog geen overeenstemming. De oudste hypothese is dat het eiwit een stopsignaal afgeeft aan de migrerende cellen. Dit lijkt te worden bevestigd door het feit dat reeline dissociatie in gang kan zetten, waarbij de migrerende zenuwcellen van hun "leidende" gliacellen worden losgemaakt om als individuele cellen verder te gaan. Daarnaast speelt het eiwit een rol bij de handhaving van de compacte laag granulecellen in de hippocampus. | Over de precieze manier waarop reeline de tangentiële migratie en daarmee de uiteindelijke volgorde van de hersenschorslagen beïnvloedt bestaat echter nog geen overeenstemming. De oudste hypothese is dat het eiwit een stopsignaal afgeeft aan de migrerende cellen. Dit lijkt te worden bevestigd door het feit dat reeline dissociatie in gang kan zetten, waarbij de migrerende zenuwcellen van hun "leidende" gliacellen worden losgemaakt om als individuele cellen verder te gaan. Daarnaast speelt het eiwit een rol bij de handhaving van de compacte laag granulecellen in de hippocampus. Reeline-rijke gebieden worden gemeden door migrerende neuroblasten, wat erop wijst dat reeline celafstotend werkt.<ref name="Hack I 2002">Hack I, Bancila M, Loulier K, Carroll P, Cremer H (oktober 2002). "Reelin is a detachment signal in tangential chain-migration during postnatal neurogenesis". Nat. Neurosci. 5 (10): 939–45. doi:10.1038/nn923. {{PMID|12244323}}.</ref><ref>http://www3.interscience.wiley.com/journal/119175475/abstract</ref> | ||
Het feit dat de corticogenese bij sommige muizen normaal verloopt ondanks een verkeerde rangschikking van de reeline-exprimerende hersenschorslagen<ref>Yoshida M, Assimacopoulos S, Jones KR, Grove EA ( | Het feit dat de corticogenese bij sommige muizen normaal verloopt ondanks een verkeerde rangschikking van de reeline-exprimerende hersenschorslagen<ref>Yoshida M, Assimacopoulos S, Jones KR, Grove EA (februari 2006). "Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order". Development 133 (3): 537–45. doi:10.1242/dev.02209. {{PMID|16410414}}.</ref> en het gebrek aan bewijs dat reeline de groeikegels en sturende zenuwuiteinden beïnvloedt laat ook ruimte voor andere mogelijkheden. Zo zou reeline de cellen bijvoorbeeld extra gevoelig kunnen maken voor bepaalde grote hoeveelheden signaleringscascades, doordat het eiwit tijdens de postnatale neurogenese de migrerende voorlopers van de zenuwcellen beïnvloedt middels een signaal dat deze cellen van de [[gliacel]]len scheidt (zie ook [[Transductie (fysiologie)|transductie]]).<ref name="Hack I 2002" /><ref name="Yoshida M 2006">{{en}}Yoshida M, Assimacopoulos S, Jones KR, Grove EA (februari 2006). "Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order". Development 133 (3): 537–45. doi:10.1242/dev.02209. {{PMID|16410414}}.</ref> Daarnaast is het goed mogelijk dat reeline een belangrijke rol speelt bij het op hun plaats terechtkomen van autonome zenuwcellen in de [[wervelkolom]].<ref>{{en}}http://www.pnas.org/content/97/15/8612.full</ref> | ||
===Rol in de | === Rol in evolutie van de hersenen === | ||
De vermeerderde expressie van het | {{Zie hoofdartikel|Evolutie (biologie)}} | ||
Een belangrijk verschil tussen zoogdieren en [[Reptielen|sauropsida]], waaronder vogels, is de ontwikkeling bij de zoogdieren van de Cajal-Retzius cellen. Deze cellen zijn een speciaal soort neuronen die worden gegenereerd in de ventriculaire zone die gelegen is op de grens tussen het dorsale en ventrale telencephalon, en ook op de rand van de zich ontwikkelende cortex. Cajal-Retzius cellen zijn de belangrijkste bron van reeline. Gedurende de embryonale ontwikkeling migreren ze van hun plaats van herkomst naar de marginale zone en door de afscheiding van reeline controleren ze de radiale migratie en laminaire positionering van piramidale neuronen van de corticale plaat. De vermeerderde expressie van het reeline-gen en Dab1 in de marginale zone in combinatie met de interactie van reeline met DAB1 heeft vermoedelijk een zeer belangrijke rol gespeeld bij de ontwikkeling van de meerlagige hersenschors bij moderne zoogdieren, die bij de lagere [[amniota]] uit slechts één enkele laag bestaat.<ref>{{en}}Bar I, Lambert de Rouvroit C, Goffinet AM (december 2000). "The evolution of cortical development. An hypothesis based on the role of the Reelin signaling pathway". Trends Neurosci. 23 (12): 633–8. doi:10.1016/S0166-2236(00)01675-1. {{PMID|11137154}}.</ref> De ''reeler''-mutant laat een omgekeerde gelaagdheid van de cortex zien, wat de belangrijke rol van reeline aantoont in de juiste ontwikkeling van de cortex. | |||
Sauropsida zoals schildpadden, krokodillen, hagedissen en vogels bezitten tijdens de ontwikkeling van de cortex inderdaad schaarse cellen die reeline tot expressie brengen in het [[Grote hersenen|telencephalon]]. Deze lagere expressie van reeline is blijkbaar het gevolg van het ontbreken van Cajal-Retzius cellen in de ventriculaire zone. Er is met experimentele manipulatie aangetoond dat de toename van cellen die reeline tot expressie brengen in de dorsale cortex van vogels, de patronen van neuronale migratie wijzigen, wat suggereert dat de toename van reeline-signalering een sleutelstap was in de evolutie van de neocortex van zoogdieren.<ref>{{Citeer tijdschrift |achternaam=Franchini |voornaam=Lucía Florencia |titel=Genetic Mechanisms Underlying Cortical Evolution in Mammals |url=https://www.frontiersin.org/articles/10.3389/fcell.2021.591017 |jaargang=9 |tijdschrift=Frontiers in Cell and Developmental Biology |datum=2021 |doi=10.3389/fcell.2021.591017/full#b213 |issn=2296-634X}}</ref> Aangezien in de menselijke hersenen de Cajal-Retzius cellen een zeer uitgebreid netwerk van [[axon]]en vormen, is de expressie van reeline hier maximaal.<ref>{{en}}Molnár Z, Métin C, Stoykova A, et al. (februari 2006). "Comparative aspects of cerebral cortical development". Eur. J. Neurosci. 23 (4): 921–34. doi:10.1111/j.1460-9568.2006.04611.x. {{PMID|16519657}}</ref><ref>{{Citeer tijdschrift |achternaam=Nomura |voornaam=Tadashi |titel=Patterns of Neurogenesis and Amplitude of Reelin Expression Are Essential for Making a Mammalian-Type Cortex |url=https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0001454 |jaargang=3 |tijdschrift=PLOS ONE |datum=2008-01-16 |taal=en |nummer=1 |doi=10.1371/journal.pone.0001454 |issn=1932-6203 |pmid=18197264 |pmc=PMC2175532 |pagina's=e1454 |last2=Takahashi |first2=Masanori |last3=Hara |first3=Yoshinobu |last4=Osumi |first4=Noriko}}</ref> | |||
In 2007 werd | In 2007 werd ontdekt dat een bepaalde variant van het gen DAB1 alleen bij de [[Volksrepubliek China|Chinese]] bevolking voorkomt, een aanwijzing dat het reactiepad van reeline nog steeds muteert.<ref>{{en}}Williamson SH, Hubisz MJ, Clark AG, Payseur BA, Bustamante CD, Nielsen R (2007). "Localizing Recent Adaptive Evolution in the Human Genome". PLoS Genetics 3 (6): e90. doi:10.1371/journal.pgen.0030090. {{PMID|17542651}}.</ref><ref>{{en}}Wade N (2007-06-26). "Humans Have Spread Globally, and Evolved Locally". Science. New York Times. http://www.nytimes.com/2007/06/26/science/26human.html?pagewanted=1. Retrieved 2008-08-23.</ref> | ||
== Mogelijke rol bij aandoeningen == | == Mogelijke rol bij aandoeningen == | ||
===Lissencefalie=== | === Lissencefalie === | ||
Mutaties van het reeline-gen lijken ten grondslag te liggen aan een zeldzame vorm van [[lissencefalie]] met [[cerebellaire hypoplasie (mensen)|onderontwikkelde kleine hersenen]], die bekendstaat als het ''[[Type-2-lissencefalie|Norman-Robertssyndroom]]''. Mensen met dit syndroom hebben een ontwikkelingsachterstand, [[Spierhypotonie|verminderde spierspanning]], [[ataxie|evenwichts- en coördinatiestoornissen]] en [[Epileptisch insult|epileptische insulten]]. De exacte rol van reeline bij deze aandoening is nog onduidelijk.<ref>{{en}} B.S. Chang et.al. (2007) [http://walshlab.org/pdf/the_role_of_RELN_in_lissencephaly.pdf The Role of RELN in Lissencephaly and Neuropsychiatric Disease] American Journal of Medical Genetics Part B 144B:58–63</ref> | |||
=== Schizofrenie === | |||
Uit post-mortem onderzoek blijkt dat in de hersenen van [[schizofrenie]]patiënten een verminderde mate van expressie van reeline en het bijbehorende [[Messenger RNA]] plaatsvindt. In sommige gebieden van de hersenen kan deze vermindering oplopen tot 50%, en gaat ze tevens gepaard met een verminderde expressie van het enzym ''GAD-67'', dat een katalysator is voor de omzetting van [[glutaminezuur]] in [[gamma-aminoboterzuur]]. Volgens een studie veranderen bij schizofrenie de hoeveelheden reeline en [[Proteïne isovorm|isovormen]] in het bloed, wat een belangrijke oorzaak van [[stemmingsstoornis]]sen zou kunnen zijn.<ref>{{Citeer tijdschrift |achternaam=Kalkman |voornaam=H. O. |titel=GAD67: the link between the GABA-deficit hypothesis and the dopaminergic- and glutamatergic theories of psychosis |url=https://doi.org/10.1007/s00702-003-0826-8 |jaargang=110 |tijdschrift=Journal of Neural Transmission |datum=2003-07-01 |taal=en |nummer=7 |doi=10.1007/s00702-003-0826-8 |issn=1435-1463 |pagina's=803–812 |last2=Loetscher |first2=E.}}</ref> | |||
==== Methylatie van het RELN-gen ==== | |||
Bij schizofrenie, maar ook bij bipolaire stoornis is de concentratie [[s-adenosyl-methionine]] (SAM) in de prefrontale cortex tweemaal zo hoog is als bij mensen zonder psychische afwijking. Dit gaat gepaard met een verhoogde expressie van het enzym DNA methyltransferase-1 mRNA. Dit kan methylatie van Cytosine veroorzaken met downregulering van de expressie van reeline tot gevolg.<ref>{{en}}Guidotti A, Ruzicka W, Grayson DR, et al. (januari 2007). "S-adenosyl methionine and DNA methyltransferase-1 mRNA overexpression in psychosis". Neuroreport 18 (1): 57–60. doi:10.1097/WNR.0b013e32800fefd7. {{PMID|17259861}}.</ref> | |||
Een andere mogelijke oorzaak van de verminderde hoeveelheden reeline-mRNA en reeline bij schizofrenie is eveneens [[Epigenetica|epigenetische]] [[Methylering|hypermethylering]] maar dan van de reeline-gen promotor.<ref>{{en}}Grayson DR, Jia X, Chen Y, et al. (juni 2005). "Reelin promoter hypermethylation in schizophrenia". Proc. Natl. Acad. Sci. U.S.A. 102 (26): 9341–6. doi:10.1073/pnas.0503736102. {{PMID|15961543}}.</ref> Deze bevindingen komen overeen met observaties uit de jaren '60, waaruit bleek dat het toedienen van [[methionine]] bij schizofreniepatiënten in 60 tot 70 % van de gevallen leidde tot een ernstige verergering van de symptomen van deze aandoening.<ref>{{en}}Pollin W, Cardon PV, Kety SS (januari 1961). "Effects of amino acid feedings in schizophrenic patients treated with iproniazid". Science (journal) 133: 104–5. doi:10.1126/science.133.3446.104. {{PMID|13736870}}.</ref><ref>{{en}}Brune GG, Himwich HE (mei 1962). "Effects of methionine loading on the behavior of schizophrenic patients". J. Nerv. Ment. Dis. 134: 447–50. doi:10.1097/00005053-196205000-00007. {{PMID|13873983}}.</ref><ref>{{en}}Park L, Baldessarini RJ, Kety SS (april 1965). "Effects of methionine ingestion in chronic schizophrenia patients treated with monoamine oxidase inhibitors". Arch. Gen. Psychiatry 12: 346–51. {{PMID|14258360}}.</ref><ref>{{en}}Antun FT, Burnett GB, Cooper AJ, Daly RJ, Smythies JR, Zealley AK (juni 1971). "The effects of L-methionine (without MAOI) in schizophrenia". J Psychiatr Res 8 (2): 63–71. doi:10.1016/0022-3956(71)90009-4. {{PMID|4932991}}.</ref> [[Methylering]]remmers en remmers van [[Histon (eiwit)|histone]] [[deacetylase]] (zoals [[valproïnezuur]]) verhogen de hoeveelheid reeline-mRNA.<ref>{{en}}Tremolizzo L, Doueiri MS, Dong E, et al. (maart 2005). "Valproate corrects the schizophrenia-like epigenetic behavioral modifications induced by methionine in mice". Biol. Psychiatry 57 (5): 500–9. doi:10.1016/j.biopsych.2004.11.046. {{PMID|15737665}}.</ref><ref>Chen Y, Sharma RP, Costa RH, Costa E, Grayson DR (juli 2002). "On the epigenetic regulation of the human reelin promoter". Nucleic Acids Res. 30 (13): 2930–9. doi:10.1093/nar/gkf401. {{PMID|12087179}}.</ref><ref>Mitchell CP, Chen Y, Kundakovic M, Costa E, Grayson DR (april 2005). "Histone deacetylase inhibitors decrease reelin promoter methylation in vitro". J. Neurochem. 93 (2): 483–92. doi:10.1111/j.1471-4159.2005.03040.x. {{PMID|15816871}}.</ref> | |||
Behandeling met L-methionine bij muizen leidde tot een [[downregulatie]] van de fenotypische expressie van reeline.<ref>Tremolizzo L, Carboni G, Ruzicka WB, et al. (december 2002). "An epigenetic mouse model for molecular and behavioral neuropathologies related to schizophrenia vulnerability". Proc. Natl. Acad. Sci. U.S.A. 99 (26): 17095–100. doi:10.1073/pnas.262658999. {{PMID|12481028}}.</ref> | |||
Dit alles lijkt de epigenetische hypothese met betrekking tot de rol van reeline in schizofrenie te bevestigen.<ref>{{en}}http://www.schizophreniaforum.org/for/curr/grayson/default.asp</ref> | |||
==== | ==== Genetische oorzaken ==== | ||
Het chromosoomgebied [[7q22]] is de locatie van het reeline-gen. Dit gebied wordt daarnaast verondersteld een rol te spelen bij schizofrenie.<ref name="Wedenoja J 2007">Wedenoja J, Loukola A, Tuulio-Henriksson A, Paunio T, Ekelund J, Silander K, Varilo T, Heikkilä K, Suvisaari J, Partonen T, Lönnqvist J, Peltonen L (2007). "Replication of linkage on chromosome 7q22 and association of the regional Reelin gene with working memory in schizophrenia families". Mol Psychiatry 13: 673. doi:10.1038/sj.mp.4002047. {{PMID|17684500}}.</ref> Het gen zelf is met schizofrenie in verband gebracht in een uitgebreide studie, waarin bleek dat het [[polymorfisme (genetica)|polymorfisme]] [[rs7341475]] het risico op schizofrenie wel bij vrouwen maar niet bij mannen verhoogde. Vrouwen met dit [[Enkel-nucleotide-polymorfie|enkel-nucleotide polymorfisme]] lopen volgens deze studie 1,4x zoveel kans op schizofrenie.<ref>{{en}}Shifman S, Johannesson M, Bronstein M, Chen SX, Collier DA, Craddock NJ, Kendler KS, Li T, O'Donovan M, O'Neill FA, Owen MJ, Walsh D, Weinberger DR, Sun C, Flint J, Darvasi A (2008). "Genome-Wide Association Identifies a Common Variant in the Reelin Gene That Increases the Risk of Schizophrenia Only in Women". PLoS Genet. 4 (2): e28.</ref> Bij families waarin schizofrenie voorkomt zijn variaties in het RELN-[[allel]] in verband gebracht met het [[Werkgeheugen (mens)|werkgeheugen]].<ref name="Wedenoja J 2007" /><ref>{{en}}Gregório SP, Sallet PC, Do KA, Lin E, Gattaz WF, Dias-Neto E (december 2008). "Polymorphisms in genes involved in neurodevelopment mei be associated with altered brain morphology in schizophrenia: Preliminary evidence". Psychiatry Res 165: 1. doi:10.1016/j.psychres.2007.08.011. {{PMID|19054571}}. http://linkinghub.elsevier.com/retrieve/pii/S0165-1781(07)00298-3.</ref> | |||
Een andere studie toont aan dat schizofreniepatiënten in de perifere [[lymfocyt]]en een verminderde hoeveelheid VLDL-receptoren (VLDLR) hebben.<ref name="Suzuki K 2007">Suzuki K, Nakamura K, Iwata Y, Sekine Y, Kawai M, Sugihara G, Tsuchiya KJ, Suda S, Matsuzaki H, Takei N, Hashimoto K, Mori N (2007). "Decreased expression of reelin receptor VLDLR in peripheral lymphocytes of drug-naive schizophrenic patients". Schizophrenia Research 98: 148. doi:10.1016/j.schres.2007.09.029. {{PMID|17936586}}.</ref> Na een half jaar durende behandeling met [[Antipsychoticum|antipsychotica]] steeg de expressie. | |||
Ook de interactie van reeline met bepaalde [[risicogen]]en speelt mogelijk een rol bij schizofrenie en andere psychische aandoeningen. Een voorbeeld is de neuronale [[transcriptiefactor]] [[NPAS3]], waarvan de verstoring mogelijk de basis vormt voor schizofrenie en achterstanden in het leerproces.<ref>Kamnasaran D, Muir WJ, Ferguson-Smith MA, Cox DW (mei 2003). "Disruption of the neuronal PAS3 gene in a family affected with schizophrenia". J. Med. Genet. 40 (5): 325–32. doi:10.1136/jmg.40.5.325. {{PMID|12746393}}.</ref> [[Knock-out (biologie)|Knockout]]-muizen die dit of het gelijksoortige eiwit [[NPAS1]] missen hebben aanzienlijk minder reeline.<ref>{{en}}Erbel-Sieler C, Dudley C, Zhou Y, et al. (september 2004). "Behavioral and regulatory abnormalities in mice deficient in the NPAS1 and NPAS3 transcription factors". Proc. Natl. Acad. Sci. U.S.A. 101 (37): 13648–53. doi:10.1073/pnas.0405310101. {{PMID|15347806}}.</ref> Een ander voorbeeld is het met schizofrenie verband houdende gen [[methylenetetrahydrofolate reductase]] waarvan het product de formatie van methione regelt. Muizen (en vermoedelijk mensen) met een tekort aan dit gen hebben een verminderde hoeveelheid reeline in het cerebellum.<ref>Chen Z, Schwahn BC, Wu Q, He X, Rozen R (augustus 2005). "Postnatal cerebellar defects in mice deficient in methylenetetrahydrofolate reductase". Int. J. Dev. Neurosci. 23 (5): 465–74. doi:10.1016/j.ijdevneu.2005.05.007. {{PMID|15979267}}.</ref> | |||
=== | === Bipolaire stoornis === | ||
Post-mortem onderzoek van menselijke hersenen heeft aangetoond dat een verminderde expressie van het reeline-gen in combinatie met [[upregulatie]] van het enzym [[DNMT1]] kenmerkend is voor [[bipolaire stoornis]]sen in combinatie met psychose.<ref name="Guidotti A 2000">Guidotti A, Auta J, Davis JM, et al. (november 2000). "Decrease in reelin and glutamic acid decarboxylase67 (GAD67) expression in schizophrenia and bipolar disorder: a postmortem brain study". Arch. Gen. Psychiatry 57 (11): 1061–9. doi:10.1001/archpsyc.57.11.1061. {{PMID|11074872}}.</ref> Volgens een onderzoek uit 2006 is bij mensen met een bipolaire stoornis de hoeveelheid DNMT1 en bijgevolg ook de hoeveelheid reeline en GAD67 in de [[basale ganglia]] op normaal niveau, terwijl in de prefrontale cortex sprake is van dezelfde afwijkingen als bij schizofreniepatiënten.<ref name="Veldic M 2007">Veldic M, Kadriu B, Maloku E, Agis-Balboa RC, Guidotti A, Davis JM, Costa E (maart 2007). "Epigenetic mechanisms expressed in basal ganglia GABAergic neurons differentiate schizophrenia from bipolar disorder". Schizophr. Res. 91 (1-3): 51–61. doi:10.1016/j.schres.2006.11.029. {{PMID|17270400}}.</ref> | |||
In 2009 kwamen aanwijzingen dat veranderingen van het RELN-gen ([[Enkel-nucleotide polymorfisme|SNP]] [[rs362719]]) specifiek verband houden met bipolaire stoornis bij vrouwen. | |||
=== Depressie === | |||
Een verminderde hippocampale plasticiteit werkt depressies in de hand en kan het gevolg zijn van een verminderde reeline-expressie. Dit zou tevens verband kunnen houden met de veronderstelde rol van [[corticosteroïde]]n bij depressies.<ref name="sciencedirect.com">{{en}}http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6T0G-4WCSRDP-C&_user=10&_rdoc=1&_fmt=&_orig=search&_sort=d&_docanchor=&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=8040712de0be3def8096317e82092441</ref> | |||
=== | === Autisme === | ||
[[Autisme]] is een [[pervasieve ontwikkelingsstoornis]] die zowel genetisch als door de omgeving kan worden veroorzaakt. Op genetisch vlak kan autisme gelinkt worden aan een aantal defecten aan [[chromosoom 7]]. Het reeline-gen bevindt zich eveneens op dit chromosoom. Over de rol van reeline bij autisme is echter nog weinig duidelijk. In de post-mortem onderzochte hersenen van mensen met autisme zijn verminderde hoeveelheden reeline aangetroffen. Onderzoek naar het veronderstelde verband tussen reeline en autisme heeft echter tot nu toe alleen tegenstrijdige resultaten opgeleverd.<ref>{{en}}Pardo CA, Eberhart CG (oktober 2007). "The neurobiology of autism". Brain Pathol. 17 (4): 434–47. doi:10.1111/j.1750-3639.2007.00102.x. {{PMID|17919129}}.</ref> | |||
=== | === Temporalekwabepilepsie === | ||
Een verstoring van de neuronale migratie als gevolg van een verminderde expressie van reeline in het weefsel van de hippocampus lijkt bij een deel van de patiënten rechtstreeks verband te houden met de migratie van [[Korrelcel|korrelcellen]], en daarmee met epilepsie aan de [[temporale kwab]]. Verhoogde hypermethylering van de reeline-promotor speelt ook een rol.<ref>{{en}}Haas CA, Dudeck O, Kirsch M, et al. (juli 2002). "Role for reelin in the development of granule cell dispersion in temporal lobe epilepsy". J. Neurosci. 22 (14): 5797–802. doi:20026621 (inactive 2008-07-08). {{PMID|12122039}}.</ref><ref>Heinrich C, Nitta N, Flubacher A, et al. (april 2006). "Reelin deficiency and displacement of mature neurons, but not neurogenesis, underlie the formation of granule cell dispersion in the epileptic hippocampus". J. Neurosci. 26 (17): 4701–13. doi:10.1523/JNEUROSCI.5516-05.2006. {{PMID|16641251}}.</ref><ref>{{en}}http://www.ncbi.nlm.nih.gov/pubmed/19287316</ref> | |||
Uit ander onderzoek blijkt dat reeline bij ratten en andere [[knaagdier]]en de migratie van [[Voorlopercel|progenitorcellen]] van granulecellen (DGC) aanstuurt en zo de integratie van deze cellen in de gyrus dentatus regelt. Dit gebeurt zowel bij ongeboren als bij volwassen exemplaren. Dissociatie van de migrerende neuroblasten zonder reeline verloopt niet goed. DGC-cellen spelen op hun beurt een grote rol bij epileptische aanvallen.<ref>{{en}}Gong C, Wang TW, Huang HS, Parent JM (februari 2007). "Reelin regulates neuronal progenitor migration in intact and epileptic hippocampus". J. Neurosci. 27 (8): 1803–11. doi:10.1523/JNEUROSCI.3111-06.2007. {{PMID|17314278}}.</ref> | |||
In een door middel van [[kaïnezuur]] opgewekt experimenteel epilepsiemodel bij muizen heeft toegediend reeline de voor [[temporalekwabepilepsie]] typische verspreiding van DGC-cellen als gevolg van een verstoorde migratie voorkomen.<ref>{{en}}Müller MC, Osswald M, Tinnes S, Häussler U, Jacobi A, Förster E, Frotscher M, Haas CA (januari 2009). "Exogenous reelin prevents granule cell dispersion in experimental epilepsy". Exp. Neurol. 216: 390. doi:10.1016/j.expneurol.2008.12.029. {{PMID|19185570}}. http://linkinghub.elsevier.com/retrieve/pii/S0014-4886(08)00482-2.</ref> | |||
=== Ziekte van Alzheimer === | |||
Volgens een studie gaat de ziekte van Alzheimer gepaard met een veranderd patroon van zowel de reeline-expressie als de [[glycosylering]]. De in de cortex van onderzochte alzheimerpatiënten aangetroffen hoeveelheid reeline was 40% hoger dan gebruikelijk, terwijl de hoeveelheid eiwit in het cerebellum hetzelfde was als bij mensen zonder Alzheimer.<ref>{{en}}Botella-López A, Burgaya F, Gavín R, et al. (april 2006). "Reelin expression and glycosylation patterns are altered in Alzheimer's disease". Proc. Natl. Acad. Sci. U.S.A. 103 (14): 5573–8. doi:10.1073/pnas.0601279103. {{PMID|16567613}}.</ref> Dit komt overeen met een eerdere studie van het expressiepatroon bij dubbel-transgene muizen waarbij zowel [[Amyloïde plaques|APP]] als [[presiniline]]s worden geëxprimeerd.<ref>{{en}}Wirths O, Multhaup G, Czech C, et al. (december 2001). "Reelin in plaques of beta-amyloid precursor protein and presenilin-1 double-transgenic mice". Neurosci. Lett. 316 (3): 145–8. doi:10.1016/S0304-3940(01)02399-0. {{PMID|11744223}}.</ref> Het aantal Cajal-Retziuscellen in de eerste corticale laag dat reeline aanmaakt is daarentegen abnormaal laag bij Alzheimer-patiënten, waardoor de [[synaptogenese]] negatief wordt beïnvloed.<ref>Baloyannis SJ (juli 2005). "Morphological and morphometric alterations of Cajal-Retzius cells in early cases of Alzheimer's disease: a Golgi and electron microscope study". Int. J. Neurosci. 115 (7): 965–80. doi:10.1080/00207450590901396. {{PMID|16051543}}.</ref><ref>{{en}}Baloyannis SJ, Costa V, Mauroudis I, Psaroulis D, Manolides SL, Manolides LS (april 2007). "Dendritic and spinal pathology in the acoustic cortex in Alzheimer's disease: morphological and morphometric estimation by Golgi technique and electron microscopy". Acta Otolaryngol. 127 (4): 351–4. doi:10.1080/00016480601126986. {{PMID|17453452}}.</ref> | |||
Een uitgebreide studie uit 2008 toonde aan dat veranderingen in het RELN-gen bij vrouwen verband zou houden met een toegenomen kans op Alzheimer.<ref>{{en}}Seripa D, Matera MG, Franceschi M, et al. (juli 2008). "The RELN locus in Alzheimer's disease". J. Alzheimers Dis. 14 (3): 335–44. {{PMID|18599960}}. http://iospress.metapress.com/openurl.asp?genre=article&issn=1387-2877&volume=14&issue=3&spage=335.</ref> Reeline interageert met het [[Amyloïde plaques|amyloïde]] precursor eiwit, wat de ontwikkeling van [[neuriet]]en stimuleert.<ref>{{en}}Hoe HS, Lee KJ, Carney RS, Lee J, Markova A, Lee JY, Howell BW, Hyman BT, Pak DT, Bu G, Rebeck GW (juni 2009). "Interaction of reelin with amyloid precursor protein promotes neurite outgrowth". J. Neurosci. 29 (23): 7459–73. doi:10.1523/JNEUROSCI.4872-08.2009. {{PMID|19515914}}. http://www.jneurosci.org/cgi/pmidlookup?view=long&pmid=19515914.</ref> Ook gaat het mogelijk de beta- [[Amyloïde plaques|amyloïde]] geïnduceerde onderdrukking van de goede werking van [[NMDA-receptor]]en tegen.<ref>{{en}}http://www.ncbi.nlm.nih.gov/pubmed/19805234</ref><ref>[http://archive.is/yGA8 New findings about brain proteins suggest possible way to fight Alzheimer's]</ref> | |||
=== Kanker === | |||
===Kanker=== | |||
{{Zie hoofdartikel|Kanker}} | {{Zie hoofdartikel|Kanker}} | ||
Bij [[tumor]]en verandert vaak het patroon van de [[DNA-methylering | Bij [[tumor]]en verandert vaak het patroon van de [[DNA-methylering]]. Hierdoor wordt ook het RELN-gen mogelijk beïnvloed. Volgens een studie wordt bij [[alvleesklierkanker]] de expressie van reeline onderdrukt, waardoor ook de pathway van het eiwit verstoord raakt. Bij kankercellen die het eiwit nog wel exprimeerden leidde het onderdrukken van deze expressie tot een toegenomen [[Uitzaaiing|metastase]].<ref>{{en}}Sato N, Fukushima N, Chang R, Matsubayashi H, Goggins M. (2006) Differential and epigenetic gene expression profiling identifies frequent disruption of the RELN pathway in pancreatic cancers. Gastroenterology. 130(2):548-65. {{PMID|16472607}}</ref> Bij [[prostaatkanker]] blijkt de expressie van reeline daarentegen juist aan de hoge kant te zijn, en bovendien rechtstreeks samen te hangen met een hoge [[Gleasonscore]], die duidt op een agressieve vorm van kanker.<ref>{{en}}Perrone G, Vincenzi B, Zagami M, Santini D, Panteri R, Flammia G, Verzi A, Lepanto D, Morini S, Russo A, Bazan V, Tomasino RM, Morello V, Tonini G, Rabitti C. (2007) Reelin expression in human prostate cancer: a marker of tumor aggressiveness based on correlation with grade. Modern Pathology. doi:10.1038/modpathol.3800743. {{PMID|17277764}}</ref> Ook bij [[retinoblastoom]] is uit weefselstudie een verhoogde expressie van onder meer het reelinegen gebleken.<ref>{{en}}http://www.molvis.org/molvis/v13/a90/</ref> | ||
===Andere ziekten=== | === Andere ziekten === | ||
Volgens een | Volgens een genoombrede associatie-studie met 550.0000 [[enkel-nucleotide polymorfisme]]n speelt mutatie van het reeline-gen een rol bij [[otosclerose]].<ref>{{en}}Schrauwen I, Ealy M, Huentelman MJ, Thys M, Homer N, Vanderstraeten K, Fransen E, Corneveaux JJ, Craig DW, Claustres M, Cremers CW, Dhooge I, Van de Heyning P, Vincent R, Offeciers E, Smith RJ, Van Camp G (februari 2009). "A Genome-wide Analysis Identifies Genetic Variants in the RELN Gene Associated with Otosclerosis". Am. J. Hum. Genet. 84: 328. doi:10.1016/j.ajhg.2009.01.023. {{PMID|19230858}}.</ref> | ||
Nieuw onderzoek bij muizen heeft uitgewezen dat een verhoogde expressie van zowel DAB1 als RELN mogelijk een rol speelt bij het beschermen tegen cerebrale [[malaria]]. Bij muizen die weerstand bieden tegen malaria remt de activering van het RELN vermoedelijk de beschadiging van zenuwcellen en de Tau-fosforylering.<ref>{{en}}Delahaye NF, Coltel N, Puthier D, Barbier M, Benech P, Joly F, Iraqi FA, Grau GE, Nguyen C, Rihet P (2007). "Gene expression analysis reveals early changes in several molecular pathways in cerebral malaria-susceptible mice versus cerebral malaria-resistant mice". BMC Genomics 8: 452. doi:10.1186/1471-2164-8-452. {{PMID|18062806}}. PMC 2246131. http://www.biomedcentral.com/1471-2164/8/452.</ref> | |||
== Reeline en psychofarmaca == | |||
Uit post-mortem onderzoeken is gebleken dat reeline bij een groot aantal afwijkingen aan de hersenen is betrokken, waarmee het mogelijk een rol heeft als psychofarmaceutisch geneesmiddel. | |||
[[ | Van [[valproïnezuur]], dat een [[Inhibitie van enzymen|inhibitor]] is van histone deacetylase, wordt gedacht dat het een positieve werking heeft wanneer het wordt ingenomen in combinatie met [[Antipsychoticum|antipsychotica]]. Uit een experiment van Fatemi et al., waarbij gedurende 21 dagen van [[peritoneale injectie]]s de hoeveelheid RELN mRNA en reeline in de prefrontale cortex van ratten werd gemeten, bleek anderzijds geen verhoogde reeline-expressie als gevolg van valproïnezuur.<ref>{{Citeer boek |titel=Reelin glycoprotein: structure, biology and roles in health and disease |uitgever=Springer |plaats=New York, NY |datum=2008 |isbn=978-0-387-76760-4}}</ref> De resultaten van het betreffende experiment waren als volgt: | ||
{| class="wikitable" style="text-align:center" | {| class="wikitable" style="text-align:center" | ||
| Regel 218: | Regel 215: | ||
! width="85" | [[Fluoxetine]] | ! width="85" | [[Fluoxetine]] | ||
! width="85" | [[Haloperidol]] | ! width="85" | [[Haloperidol]] | ||
! width="85" | [[Lithium]] | ! width="85" | [[Lithium (element)|Lithium]] | ||
! width="85" | [[Olanzapine]] | ! width="85" | [[Olanzapine]] | ||
! width="85" | [[Valproïnezuur]] | ! width="85" | [[Valproïnezuur]] | ||
| Regel 227: | Regel 224: | ||
|} | |} | ||
In een nieuwe studie van | In een nieuwe studie van Fatemi et al. werd behalve de corticale expressie van reeline ook die van VLDLR, DAB1, [[GSK3beta]], [[GAD65]] en [[GAD67]] gemeten.<ref>{{en}}Fatemi SH, Reutiman TJ, Folsom TD (april 2009). "Chronic psychotropic drug treatment causes differential expression of Reelin signaling system in frontal cortex of rats". Schizophr. Res.. doi:10.1016/j.schres.2009.03.002. {{PMID|19359144}}. http://linkinghub.elsevier.com/retrieve/pii/S0920-9964(09)00086-3.</ref> | ||
== Literatuur == | |||
*Het boek: {{Cite book |author=Fatemi, S. Hossein |authorlink= |editor= |others= |title=Reelin Glycoprotein: Structure, Biology and Roles in Health and Disease |edition= |language= |publisher=Springer |location=Berlin |date=2008 |origdate= |pages=444 pages |quote= |isbn=978-0-387-76760-4 |oclc= |doi= |url=http://www.springer.com/biomed/neuroscience/book/978-0-387-76760-4 |accessdate=}} | |||
* Een recensie: {{Cite journal |author=Förster E, Jossin Y, Zhao S, Chai X, Frotscher M, Goffinet AM |title=Recent progress in understanding the role of Reelin in radial neuronal migration, with specific emphasis on the dentate gyrus |journal=Eur. J. Neurosci. |volume=23 |issue=4 |pages=901–9 |year=2006 |month=februari |pmid=16519655 |doi=10.1111/j.1460-9568.2006.04612.x |url=}} | |||
== Externe links == | |||
{{Commonscatklein|Reelin|reeline}} | |||
=== Artikels, publicaties, websites === | |||
* {{Citeer web | url = http://archive.is/fkYO | title = Gabriella D'Arcangelo | author = | authorlink = | coauthors = | date = | work = | publisher = Rutgers University | pages = | language = | archiveurl = | archivedate = | quote = the scientist who discovered the reelin gene and protein | accessdate = 2008-08-23}} | |||
* [http://www.wikigenes.org/e/gene/e/5649.html www.wikigenes.org] | |||
== | === Figuren en afbeeldingen === | ||
* | * {{Citeer web | url = http://web.archive.org/web/20050123114225/http://www.stjudebgem.org/web/view/probe/viewProbeDetails.php?id=404 | title = Expressie van het reelinegen bij muizen| author = | authorlink = | coauthors = | date = | format = | work =| publisher = St. Jude Children’s Research Hospital | pages = | language = | archiveurl = | archivedate = | quote = | accessdate = 2008-08-23}} | ||
* {{Citeer web | url = http://www.jlr.org/cgi/content-nw/full/45/3/403/FIG4 | title = Schematische weergave van de signalen via de receptoren apoER2 en VLDL | author = | authorlink = | coauthors = | date = | format = | work = | publisher = | pages = | language = | archiveurl = | archivedate = | quote = | accessdate = 2008-08-23}} – Een afbeelding van {{Cite journal | author = Beffert U, Stolt PC, Herz J | title = Functions of lipoprotein receptors in neurons | journal = J. Lipid Res. | volume = 45 | issue = 3 | pages = 403–9 | year = 2004 | month = maart | pmid = 14657206 | doi = 10.1194/jlr.R300017-JLR200 | url =}} | |||
* {{Citeer web | url = http://www.pnas.org/cgi/content-nw/full/102/35/12578/FIG5 | title = Voorgesteld mechanisme dat de afscheiding van reelin bij muizen reguleert | author = | authorlink = | coauthors = | date = | format = | work = | publisher = Proc. Natl. Acad. Sci. USA | pages = | language = | archiveurl = | archivedate = | quote = | accessdate = 2008-08-23}} – A figure from {{Cite journal |author=Dong E, Agis-Balboa RC, Simonini MV, Grayson DR, Costa E, Guidotti A |title=Reelin and glutamic acid decarboxylase67 promoter remodeling in an epigenetic methionine-induced mouse model of schizophrenia |journal=Proc. Natl. Acad. Sci. U.S.A. |volume=102 |issue=35 |pages=12578–83 |year=2005 |month=augustus |pmid=16113080 |doi=10.1073/pnas.0505394102 |url=}} | |||
* {{Citeer web | url = http://www.sciencedirect.com/science?_ob=MiamiCaptionURL&_method=retrieve&_udi=B6VRT-44PC6R0-G&_image=fig2&_ba=2&_user=10&_coverDate=12%2F11%2F2001&_fmt=full&_orig=search&_cdi=6243&_qd=1&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=61889242c72086d56e74e498ceadd958 | title = Corticogenesis bij muizen | author = | authorlink = | coauthors = | date = | format = | work = | publisher = | pages = | language = | archiveurl = | archivedate = | quote = Pictorial rendition of the difference that the lack of reelin brings to the cortical structure | accessdate = 2008-08-23}} – A figure from {{Cite journal | author = Magdaleno SM, Curran T | title = Brain development: integrins and the Reelin pathway | journal = Curr. Biol. | volume = 11 | issue = 24 | pages = R1032–5 | year = 2001 | month = december | pmid = 11747842 | doi = 10.1016/S0960-9822(01)00618-2 | url =}} | |||
* {{Citeer web | url = http://www.nature.com/ng/journal/v26/n1/fig_tab/ng0900_93_F5.html | title = Effecten van natuurlijke en kunstmatige RELN-mutaties op het voorspelde eiwit. | author = | authorlink = | coauthors = | date = | work = | publisher = Nature Genetics | pages = | language = | archiveurl = | archivedate = | quote = | accessdate = 2008-08-23}} Een afbeelding van {{Cite journal |author=Hong SE, Shugart YY, Huang DT, ''et al.'' |title=Autosomal recessive lissencephaly with cerebellar hypoplasia is associated with human RELN mutations |journal=Nat. Genet. |volume=26 |issue=1 |pages=93–6 |year=2000 |month=september |pmid=10973257 |doi=10.1038/79246 |url=}} | |||
* {{Citeer web | url = http://www.nature.com/ng/journal/v26/n1/fig_tab/ng0900_93_F2.html | title = MRI-analyse | author = | authorlink = | coauthors = | date = | work = | publisher = Nature Genetics | pages = | language = | archiveurl = | archivedate = | quote = | accessdate = 2008-08-23}} – Een afbeelding van Hong et al. | |||
{{Appendix|2= | |||
{{Appendix | * {{Bronvermelding anderstalige Wikipedia|taal=en|titel=Reelin|datum=|sectie=}} | ||
{{ | {{References-scroll}} | ||
}} | |||
[[Categorie: | [[Categorie:Proteïne]]<br> | ||
[[Categorie: | [[Categorie:Fysiologie]]<br> | ||
[[Categorie:Signaaloverdracht in cellen]]<br> | |||
[[Categorie:Hersenen]]<br> | |||
Huidige versie van 20 apr 2024 om 19:47
| Reeline | ||
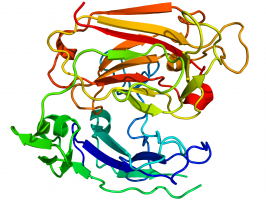
| ||
| Kristallografische structuur van reeline. | ||
| Identificatoren | ||
| Symbol(en) | RELN RL | |
| Entrez | 5649 | |
| OMIM | 600514 | |
| RefSeq | NM_005045 | |
| UniProt | P78509 | |
| PDB | 2ddu | |
| Andere data | ||
| Locus | Chr. 7 q22 | |
Reeline is een eiwit dat behoort tot de glycoproteïnen. Het wordt voornamelijk afgescheiden in de hersenen van gewervelden en zorgt daar gedurende de embryonale ontwikkeling voor een correcte migratie van de gliacellen en vervolgens ook van de neuronen naar de verschillende lagen in de neocortex. Wanneer het gen voor reeline of dat van zijn receptoren muteert of sterk wordt gemethyleerd, waardoor de expressie van reeline of haar receptoren aanzienlijk daalt, verloopt de migratie en differentiatie van de neuronen niet goed en doen zich afwijkingen voor in de ontwikkeling van de hersenschors. Als gevolg daarvan worden de lagen in de hersenschors in de verkeerde volgorde op elkaar gestapeld en hebben ze niet de correcte structuur. De naam reeline is afgeleid van het Engelse werkwoord to reel, wat 'wankelen' betekent en verwijst naar de gevolgen van afwijkingen van het RELN-gen bij muizen die hierdoor waggelend gingen lopen. De afwijkende structuur in de hersenen heeft bij mensen zeer ernstige gevolgen voor de mentale gezondheid en kan zich uiten in bipolaire stoornissen, schizofrenie, lissencefalie, depressies, autisme en de ziekte van Alzheimer.[1]
Rol
Gedurende de embryonale ontwikkeling van zoogdieren, reptielen en vogels speelt reeline een belangrijke rol in de variatie van verbindingssterkten tussen de zenuwcellen (de synaptische plasticiteit) en de groei van kleine stekeltjes op de vertakkingen van zenuwcellen (de dendritische spines). Beide hebben een belangrijke rol in het vermogen tot leren en het geheugen. Reeline is ook belangrijk in de migratie van primitieve zenuwcellen of neuroblasten.[2][3]
Reeline wordt afgescheiden door speciale zenuwcellen, de Cajal-Retziuscellen in de zich ontwikkelende hersenschors.[4] Het eiwit moet worden afgegeven in de extracellulaire matrix, het netwerk van verschillende eiwitten dat tussen de cellen is gelegen. Hier vervult reeline haar biologische rol en functie als enzym dat als zodanig de interacties tussen de verschillende cellen beïnvloedt.[5] De verwerking ervan in kleinere fragmenten reguleren aspecten van het signaal. Reeline zou aantrekkingskracht uit kunnen oefenen op migrerende cellen of zou juist een soort 'loslaten en stop'-signaal kunnen zijn voor cellen die aan het eind van hun migratie gekomen zijn.[6] Reeline blijft ook na de ontwikkeling van het embryo van belang; het wordt bij de mens bijvoorbeeld ook in de hersenen van volwassenen gevonden waar het een rol bij het leervermogen en de werking van het geheugen speelt. Het eiwit wordt daarnaast aangetroffen in andere lichaamsweefsels zoals de lever en het oog.[7]
Structuur
Reeline wordt gecodeerd door het RELN-gen, waarvan in 1994 werd vastgesteld aan welk chromosoom het gekoppeld is. Het eiwit bestaat uit een keten van 3461 aminozuren met een moleculaire massa van 388 kDa. Deze keten bestaat in zijn primaire structuur uit twaalf blokken aminozuren. Het eerste blok is een signaalpeptide, in het schema hiernaast weergegeven met "S". Het volgende blok (in het schema hiernaast in paars met "SP" weergegeven) is vergelijkbaar met spondin 1-proteïne, een eiwit dat is betrokken bij het leiden van axons. De structuur van het derde blok, hiernaast aangegeven in rood, met "H", is specifiek van reeline.
Het grootste stuk bestaat uit een herhaling van 8 ketens, de zogeheten reelin repeats ("reelineherhalingen", hier in geel aangegeven). In hun midden hebben deze herhaalde ketens een klein peptidehormoon (aangegeven met een blauwe lijn), waardoor elke herhaalde keten uit twee subketens (A en B) bestaat. Ondanks deze onderbreking maken de subdomeinen rechtstreeks contact met elkaar, waardoor ze als geheel een compacte structuur vormen.[8]
Het laatste gedeelte omvat een zeer kort en basisch C-terminaal gebied (CTR, in het schema weergegeven als "+"). Bij bijna alle onderzochte gewervelde dieren (behalve vissen) kwam alleen dit laatste deel van de aminozuurketen voor 100% overeen, waarmee dit dus het meest conservatieve deel van reeline is.
Het RELN-gen, dat zich bij mensen op chromosoom 7 op de locus 7q22 bevindt,[9] is in veel gewervelde soorten geconserveerd, waaronder de mens. De aminozuur- en nucleotidesequenties van muis en mens zijn respectievelijk 94,2% en 87,2% identiek.[10][11]
Ontdekking
Experimenten met muizen
De ontwikkeling van het centrale zenuwstelsel op moleculair niveau wordt bestudeerd aan de hand van mutaties bij muizen. In 1951 ontdekte Douglas Scott Falconer dat een groep muizen die werd gehouden door Charlotte Auerbach een abnormaal wankelende manier van lopen vertoonde. Dit bleek het gevolg van een verstoorde ontwikkeling van hun centrale zenuwstelsel. Deze zogeheten reelermouse vertoonde de afwijking als gevolg van een mutatie van het RELN-gen. Deze afwijking was homozygoot, dat wil zeggen dat beide kopieën ofwel allelen van het gen ontbraken. Deze muizen hadden geen expressie van wat reeline genoemd werd, naar het fenotype en het gedrag van deze muizen die 'wankelden' (in het Engelse betekent to reel 'wankelen').[12]
Muizen met een heterozygote mutatie van het RELN-gen daarentegen (die een mutatie in slechts één van de twee allelen bezitten) vertonen weinig neuroanatomische afwijkingen ten opzichte van muizen met een homozygote mutatie van dit gen. De hoeveelheid reeline is daarom waarschijnlijk gehalveerd. Om die reden zijn ze interessant als model bij het onderzoek naar psychosen; bij post-mortem onderzoek op psychotische patiënten bleek namelijk dat er in de hersenen sprake van een downregulatie van het gen van 50%.[13]
Nieuw histopathologisch onderzoek in de jaren '60 wees uit dat de kleine hersenen bij dit soort muizen veel kleiner waren dan gewoonlijk, terwijl bovendien op verschillende plekken in het brein de laminaire organisatie anders was. In de jaren '70 werd ook ontdekt dat in een deel van de neocortex van deze muizen de rangschikking van de diverse celtypen en weefsels anders was dan gewoonlijk; in grote lijnen was de volgorde van cellagen omgekeerd, terwijl anderzijds de celdifferentiatie normaal leek te verlopen. Op grond hiervan verschoof de aandacht naar de specifieke fysieke eigenschappen van de zogeheten reeler-mutant.[14]
Identificatie van het reeline-gen
Reeline werd in 1995 ontdekt in twee muizenstammen, waarvan één spontaan ontstaan was en de ander transgeen was verkregen. De spontane reeler-mutant was al langer bekend en bewoog zich zoals al bekend met de wankelende gang. Dankzij de transgene muizen kon het gen gekloond worden en men vond een grote deletie die verklaarde waarom er geen transcriptie van het gen plaatsvond. De reeler mutant is daarna ook ontdekt in verschillende rattenstammen en uiteindelijk is het reeline-gen ook in de mens ontdekt en gekloond.[15]
De volgende stap was het leggen van allerlei verbanden tussen de afwezigheid van transcriptie van reeline en allerlei complexe aandoeningen, zoals autisme en de ziekte van Alzheimer. In de eerste jaren van de 21e eeuw werd er steeds meer bekend over de structuur en functie van het eiwit.
Expressie
Reeline is bijzonder belangrijk gedurende de prenatale ontwikkeling van het zenuwstelsel en de expressie ervan is het hoogst gedurende de embryonale fase.
Cajal-Retziuscellen, zenuwcellen met lange horizontale axonen, scheiden reeline af in combinatie met het eiwitproduct van het zogeheten HAR1(Human accelerated regions)-gen. Dit laatste gen heeft bij de mens een zeer sterke evolutionaire verandering doorlopen ten opzichte van de chimpansee. Dit gen wordt bij menselijke embryo's tussen de 7e en de 19e week van zwangerschap afgeschreven in de zich ontwikkelende neocortex. Reeline en HAR1 samen dragen bij aan de vorming van de typische zes-lagen structuur van de neocortex.[18]
Belangrijke expressiegebieden
Reeline wordt niet uitgescheiden via de synaptische blaasjes zoals in het geval van neurotransmitters, maar verlaat de cel met exocytose door de blaasjes van het golgi-apparaat. De snelheid waarmee het eiwit vrijkomt is dus niet afhankelijk van depolarisatie, maar wordt uitsluitend bepaald door de snelheid waarmee de synthese plaatsvindt.[19] Dit geldt ook voor de afscheiding van andere eiwitten in de extracellulaire matrix.
Aan het begin van de ontwikkeling van de hersenen wordt reeline het eerst aangetroffen in de uitwendige granulaire laag en in delen van het tectum (mesencephalon), de hypothalamus en in de wervelkolom. Vervolgens vindt migratie naar de inwendige lagen plaats. Onderzoek bij de mens van embryo's en pasgeborenen toonde aan dat de cellen waarin expressie van reeline plaatsvindt voor en kort na de geboorte vooral aangetroffen worden in de marginale zone van de hersenschors en de tijdelijk aanwezige subpiale granulaire laag (SGL). Na 11 weken zwangerschap bleek in de marginale zone een laag reeline-positieve mono- of bipolaire horizontale Cajal-Retziuscellen aanwezig. Na de 14e week vormde zich in de SGL een tweede laag reeline-positieve cellen.[20] Het eiwit wordt in de prenatale fase afgescheiden door de in de cortex en de hippocampus aanwezige Cajal-, Retzius- en Cajal-Retziuscellen. Deze laatste verdwijnen bijna en sterven grotendeels af na 27 weken, nadat de cortex gevormd is.[4]
Bij gewervelden werd in de telencephalon reeline aangetroffen. Het expressiepatroon blijkt te variëren bij verschillende diersoorten; bij zebravissen bijvoorbeeld – die geen Cajal-Retziuscellen hebben – werd het eiwit door zenuwcellen in het hele dorsale gedeelte van het pallium geëxprimeerd.[21] Ook in de hersenschors van schubreptielen bleek de verdeling van de gebieden met reeline-expressie weer anders.[22] In de cortex en hippocampus van volwassen ratten vindt de expressie hoofdzakelijk plaats in zenuwcellen, waar synthese van gamma-aminoboterzuur (GABA) plaatsvindt en door de weinige overgebleven Cajal-Retziuscellen.[23]
Behalve in de hersenen wordt reeline ook aangetroffen in het bloed (met name bij volwassen organismen), in een deel van de pars intermedia in de hypofyse en in de bijnieren. De voornaamste bron van reeline buiten de hersenen zijn de zogenaamde stercellen van de lever.[24] De concentratie van reeline in de lever is verhoogd bij een leverbeschadiging en keert na genezing terug op normaal niveau. Ook in de ogen wordt reeline afgescheiden, in het netvlies en het hoornvlies. Uit proeven met muizen blijkt dat de meeste expressie ervan plaatsvindt tijdens de ontwikkeling van het netvlies; net als in de lever neemt de expressie ook hier toe na verwondingen. Ten slotte wordt het eiwit ook nog afgescheiden door de odontoblasten aan de randen van het tandpulpa; zowel gedurende het hele proces van tandontwikkeling als in volwassen tanden wordt op deze plekken reeline aangetroffen.[25]
Andere factoren die de expressie beïnvloeden
Een post-mortem studie wees uit dat in de neocortex van personen die de puberteit al hadden doorlopen de methylering van het RELN-gen veel hoger was dan bij personen die nog niet in de puberteit waren. Methylering van DNA of histonen duidt meestal op inactivering van genen. Dit zou betekenen dat de expressie van het RELN-gen na de puberteit wordt onderdrukt.
Bij jonge ratten bleek de moederlijke zorg (licking and grooming; LG) van invloed te zijn op de dendritische structuur en functie van neuronen van de somatosensibele schors en op het transcriptoom in de hippocampus, en bijgevolg ook op de expressie van allerlei genen in deze gebieden, waaronder het reeline-gen. Het feit dat dit effect zowel kan worden gestimuleerd als afgeremd, wijst erop dat het ook nog omkeerbaar is nadat de ratten eenmaal geboren zijn.[26][27] Als gevolg van herhaaldelijke blootstelling aan corticosteron neemt het aantal reeline-positieve cellen en daarmee de expressie van reeline in de hippocampus van ratten af. Dit gegeven zou van belang kunnen zijn voor depressies waar corticosteroïden een hypothetische rol in hebben.[28]
Mechanisme
Receptoren
In 1998 werden de twee receptoren van reeline ontdekt: de lipoproteïne-receptoren ApoER2 en VLDLR. Ook toen werd het eerste verband gelegd tussen deze receptoren en het ontstaan van de ziekte van Alzheimer. Nader onderzoek wees uit dat de hersenschorslagen van zogeheten double knockout-muizen - die zowel ApoEr2 als VLDLR misten - dezelfde gebreken vertoonden als die welke bij reelermuizen werden aangetroffen. Zo werd duidelijk dat deze receptoren een belangrijke rol spelen bij de signaaltransductie van het reelinesignaal.[30]
Vervolgens bleek ook het fenotype van muizen waarbij het gen Dab1 (Disabled-1) was verstoord (yotari en scrambler) veel overeenkomsten te vertonen met dat van reelermuizen.[31][32][30]
Reeline is een ligand die hoofdzakelijk bindt aan VLDLR en ApoER2.[33] ApoER2 (Apolipoprotein E Receptor 2) is een molecuul dat zich aan het oppervlak van cellen bevindt en na binding met reeline signaaltransductie tot gevolg heeft in de cellen.[34] Dankzij deze bindingen worden clusters gevormd, die op hun beurt een cruciale rol spelen bij het verloop van de signaaltransductie. De intracellulaire adaptor DAB1 kan hierdoor op zijn beurt gaan dimeriseren of oligomeriseren. Aangetoond is dat soortgelijke clusters zelfs bij afwezigheid van reeline een dergelijke signaalketen kunnen activeren.[35]
De twee hoofdreceptoren van reeline lijken in de neuronale migratie niet helemaal dezelfde rol te spelen. Zo lijkt VLDLR hoofdzakelijk het stopsignaal voor de celmigratie door te geven, terwijl ApoER2 verantwoordelijk is voor het stimuleren van de migratie van neocorticale zenuwcellen.[36]
Interactie van het gen van ApoER2 met NMDA-receptoren vormt de basis voor vergroting van de langetermijnpotentiëring (LTP) dankzij reeline.[37]
Fosforylering van DAB1
Reelinemoleculen vormen een eiwitcomplex, het zogeheten disulfide gebonden homodimeer. Wanneer deze homodimeer niet wordt gevormd, is een goede tyrosinefosforylering van DAB1, welke nodig is voor transductie van het reelinesignaal, in vitro gedoemd te mislukken.[38][39]
De intracellulaire adaptor DAB1 gaat met VLDLR en ApoER2 een verbinding aan waarbij het een rol speelt in de transmissie van reelinesignalen via deze receptoren.[40]
Demethylering
Bij ratten neemt als gevolg van demethylering van het RELN-gen, de expressie van reeline in de hippocampus sterk toe wanneer er iets in het geheugen moet worden opgeslagen, bijvoorbeeld bij angst.[41]
Splitsing
Reeline kan op twee plekken worden gesplitst: na het tweede en het zesde domein, tussen de herhalingen 2/3 en 6/7. Hierdoor ontstaan 3 fragmenten. Deze splitsing leidt echter niet tot een verminderde eiwitactiviteit, omdat de delen die ontstaan uit de centrale fragmenten (de herhaalde aminozuurreeksen 3-6) zich binden aan de lipoproteïnereceptoren, waar ze fosforylering van het DAB1-gen in de zich ontwikkelende zenuwcellen op gang brengen en zo de rol van reeline in de zich ontwikkelende hersenschors imiteren.[42]
Andere interacties
Reeline heeft behalve met zijn receptoren en DAB-1 vele interacties met andere proteïnen. Bijvoorbeeld met integrinen die zich tijdens de vorming van de hersenschors binden aan de N-terminus van reeline, waardoor de neurale migratie wordt geremd.[43] Ook DAB1 heeft interacties en is doelwit van fosforylering waardoor het geactiveerd wordt.[44]
Reeline is een serineprotease en kan daarmee bepaalde peptideverbindingen verbreken. Hierdoor kunnen met name het verloop van de neuronale migratie en de adhesie van cellen aan fibronectine negatief worden beïnvloed.[5]
Functies
De precieze functie van reeline wordt vooral bepaald door het tijdstip waarop de expressie ervan plaatsheeft en de plaats in het lichaam waar het een rol speelt. De manier waarop het centrale of volledige deel van reeline door embryonale zenuwcellen wordt verwerkt is mogelijk in hoge mate bepalend voor een goed verloop van de signalering en de ontwikkeling van de hersenschors.[45]
Signalering
In celmigratie
Het centrale fragment van reeline, waarin de delen drie tot zes zitten, is noodzakelijk en voldoende om de functies van reeline uit te voeren. Het is net zo efficiënt als reeline van volledige lengte bij het binden aan zijn twee receptoren VLDLR en ApoER2, bij het induceren van Dab1-fosforylering en van de vorming van een goed georganiseerde corticale plaat in een organotypisch hersenschijfje dat geen reeline bevat. De proteolyse ofwel de splitsing van reeline blokkeert dus niet de functie ervan. Zowel de fragmenten als het hele reeline-eiwit worden na binding met de receptoren geïnternaliseerd en afgebroken. Het blokkeren van de splitsing van reeline voorkomt ook de fosforylering van de interne adapter Dab 1 waarbij er een afwijking ontstaat in de corticale plaat. Het is mogelijk dat de uiteinden van het reeline-eiwit in de extracellulaire matrix blijven zitten en dat het proces van splitsen van reeline nodig is om het middelste fragment de receptoren van reeline te laten bereiken.[11]
De signaleringsroute van reeline omvat de specifieke VLDLR en ApoER2-receptoren, de intracellulaire adapter Dab1 en de twee tyrosine kinasen Src en Fyn. Reeline bindt de twee receptoren die internaliseren en clusteren tot dimeren of multimeren. Dit brengt de fosforylering van Dab1 door Src en Fyn teweeg. Het gefosforyleerde Dab 1 induceert signaaltransductie met verschillende uitkomsten. De daaropvolgende ubiquitinatie van Dab 1 betekent een neerwaarts regulatie door afbraak van dit eiwit.[11]
In maturatie
Na de geboorte verdwijnen bij muizen en de mens langzaamaan de Cajal–Retziuscellen. Na de geboorte wordt reelin in volwassen muizen door verschillende soorten neuronen geproduceerd in de cortex en de hippocampus. De productie van reeline is dan vooral belangrijk voor de ontwikkeling van de dendrieten, de dendritische spine en de synapsen.[11]
Herstel van organen en weefsels
Bij muizen bleek de expressie van reeline tijdelijk hoger bij verwondingen aan de lever, in cellen in de beschadigde gebieden. Nadat de verwondingen waren genezen keerde de expressie terug tot het normale niveau.[46] Het blijft echter onduidelijk of en in hoeverre reeline-expressie betrokken is bij het herstelproces; bij een andere studie herstelden muizen zonder dit eiwit eveneens volledig.[46][47]
Zenuwstelsel
De rol die reeline speelt bij de groei en ontwikkeling van het centraal zenuwstelsel is belangrijker en hier is ook meer over bekend. Gedurende de embryonale fase speelt reeline een belangrijke rol bij de vorming hiervan, doordat het in hoge mate bijdraagt aan het aansturen van de neuronale migratie. Reeline stimuleert daarnaast de ontwikkeling van bepaalde dendrieten[2][3] en blijft ook een belangrijke rol spelen nadat de hersenen eenmaal zijn volgroeid; zo regelt reeline in deze fase bijvoorbeeld de synaptische plasticiteit.[48] Daarnaast regelt het de voortgezette migratie van nieuwe neuroblasten vanaf plekken waar tijdens de volwassenheid neurogenese plaatsvindt, zoals de subventriculaire zone en de subgranulaire zone.
Reeline stimuleert de differentiatie van progenitorcellen naar radiaire gliacellen en beïnvloedt de vezeloriëntatie hiervan. Hierdoor worden migrerende neuroblasten aangestuurd.[49] Dankzij deze oriëntatie worden onder meer de laag-specifieke verbindingen tussen de hippocampus en de entorinale schors door reeline geregeld.[50]
Ook in volwassen zenuwstelsels blijft reeline een belangrijke rol spelen in de twee meest actieve gebieden waar de neurogenese plaatsvindt: de subventriculaire zone en de gyrus dentatus. Bij sommige diersoorten migreren de neuroblasten eerst in ketens vanuit de subventriculaire zone als onderdeel van de rostrale migratoire stroom naar de bulbus olfactorius, waar ze vervolgens door de reeline worden gedissocieerd om uiteindelijk als individuele cellen verder te gaan. De migratie van deze individuele cellen verandert daarbij van tangentieel in radiair, terwijl de cellen de radiaire gliavezels gebruiken als "gids".
Volgens onderzoek functioneren de receptoren ApoER2 en VLDLR en hun intracellulaire adapter DAB1 in de postnatale neuronale migratie onafhankelijk van reeline en onder invloed van het eiwit Trombospondine-1.[51][52]
In de volgroeide gyrus dentatus fungeert reeline als sturingsmechanisme voor nieuwe neuronen die vanuit de subgranulaire zone in de laag granulecellen belanden.[53] In de volwassen hersenen draagt het eiwit voornamelijk bij aan het reguleren van de hoeveelheid afgescheiden corticale piramidecellen, de vertakking van dendrieten en de langetermijnpotentiëring.[48]
Corticogenese
Ook bij de ontwikkeling van de hersenschors bij zoogdieren speelt reeline een zeer belangrijke rol, met name in de allereerste fase waarin de zogeheten "preplaat" wordt opgesplitst in een oppervlakkige marginale zone en een tijdelijke subplaat. Tussen deze twee lagen bewegen zich volgens het "inside out"-principe de neuronale lagen.[54]
Het migreren van pas gevormde zenuwcellen naar de bovenliggende lagen is kenmerkend voor de hersenen van zoogdieren; in de zich ontwikkelende hersenschors van reptielen migreren de zenuwcellen net in de omgekeerde richting.[55] Reeline blijkt een sturende rol te hebben in de tangentiële migratie van zowel de interneuronen naar de corticale plaat als die van de pioniersneuronen naar de marginale zone.[56] Een reelinetekort heeft bij zoogdieren dan ook tot gevolg dat ook de uiteindelijke volgorde van de hersenschorslagen min of meer wordt omgedraaid.
Over de precieze manier waarop reeline de tangentiële migratie en daarmee de uiteindelijke volgorde van de hersenschorslagen beïnvloedt bestaat echter nog geen overeenstemming. De oudste hypothese is dat het eiwit een stopsignaal afgeeft aan de migrerende cellen. Dit lijkt te worden bevestigd door het feit dat reeline dissociatie in gang kan zetten, waarbij de migrerende zenuwcellen van hun "leidende" gliacellen worden losgemaakt om als individuele cellen verder te gaan. Daarnaast speelt het eiwit een rol bij de handhaving van de compacte laag granulecellen in de hippocampus. Reeline-rijke gebieden worden gemeden door migrerende neuroblasten, wat erop wijst dat reeline celafstotend werkt.[57][58]
Het feit dat de corticogenese bij sommige muizen normaal verloopt ondanks een verkeerde rangschikking van de reeline-exprimerende hersenschorslagen[59] en het gebrek aan bewijs dat reeline de groeikegels en sturende zenuwuiteinden beïnvloedt laat ook ruimte voor andere mogelijkheden. Zo zou reeline de cellen bijvoorbeeld extra gevoelig kunnen maken voor bepaalde grote hoeveelheden signaleringscascades, doordat het eiwit tijdens de postnatale neurogenese de migrerende voorlopers van de zenuwcellen beïnvloedt middels een signaal dat deze cellen van de gliacellen scheidt (zie ook transductie).[57][60] Daarnaast is het goed mogelijk dat reeline een belangrijke rol speelt bij het op hun plaats terechtkomen van autonome zenuwcellen in de wervelkolom.[61]
Rol in evolutie van de hersenen
Een belangrijk verschil tussen zoogdieren en sauropsida, waaronder vogels, is de ontwikkeling bij de zoogdieren van de Cajal-Retzius cellen. Deze cellen zijn een speciaal soort neuronen die worden gegenereerd in de ventriculaire zone die gelegen is op de grens tussen het dorsale en ventrale telencephalon, en ook op de rand van de zich ontwikkelende cortex. Cajal-Retzius cellen zijn de belangrijkste bron van reeline. Gedurende de embryonale ontwikkeling migreren ze van hun plaats van herkomst naar de marginale zone en door de afscheiding van reeline controleren ze de radiale migratie en laminaire positionering van piramidale neuronen van de corticale plaat. De vermeerderde expressie van het reeline-gen en Dab1 in de marginale zone in combinatie met de interactie van reeline met DAB1 heeft vermoedelijk een zeer belangrijke rol gespeeld bij de ontwikkeling van de meerlagige hersenschors bij moderne zoogdieren, die bij de lagere amniota uit slechts één enkele laag bestaat.[62] De reeler-mutant laat een omgekeerde gelaagdheid van de cortex zien, wat de belangrijke rol van reeline aantoont in de juiste ontwikkeling van de cortex.
Sauropsida zoals schildpadden, krokodillen, hagedissen en vogels bezitten tijdens de ontwikkeling van de cortex inderdaad schaarse cellen die reeline tot expressie brengen in het telencephalon. Deze lagere expressie van reeline is blijkbaar het gevolg van het ontbreken van Cajal-Retzius cellen in de ventriculaire zone. Er is met experimentele manipulatie aangetoond dat de toename van cellen die reeline tot expressie brengen in de dorsale cortex van vogels, de patronen van neuronale migratie wijzigen, wat suggereert dat de toename van reeline-signalering een sleutelstap was in de evolutie van de neocortex van zoogdieren.[63] Aangezien in de menselijke hersenen de Cajal-Retzius cellen een zeer uitgebreid netwerk van axonen vormen, is de expressie van reeline hier maximaal.[64][65]
In 2007 werd ontdekt dat een bepaalde variant van het gen DAB1 alleen bij de Chinese bevolking voorkomt, een aanwijzing dat het reactiepad van reeline nog steeds muteert.[66][67]
Mogelijke rol bij aandoeningen
Lissencefalie
Mutaties van het reeline-gen lijken ten grondslag te liggen aan een zeldzame vorm van lissencefalie met onderontwikkelde kleine hersenen, die bekendstaat als het Norman-Robertssyndroom. Mensen met dit syndroom hebben een ontwikkelingsachterstand, verminderde spierspanning, evenwichts- en coördinatiestoornissen en epileptische insulten. De exacte rol van reeline bij deze aandoening is nog onduidelijk.[68]
Schizofrenie
Uit post-mortem onderzoek blijkt dat in de hersenen van schizofreniepatiënten een verminderde mate van expressie van reeline en het bijbehorende Messenger RNA plaatsvindt. In sommige gebieden van de hersenen kan deze vermindering oplopen tot 50%, en gaat ze tevens gepaard met een verminderde expressie van het enzym GAD-67, dat een katalysator is voor de omzetting van glutaminezuur in gamma-aminoboterzuur. Volgens een studie veranderen bij schizofrenie de hoeveelheden reeline en isovormen in het bloed, wat een belangrijke oorzaak van stemmingsstoornissen zou kunnen zijn.[69]
Methylatie van het RELN-gen
Bij schizofrenie, maar ook bij bipolaire stoornis is de concentratie s-adenosyl-methionine (SAM) in de prefrontale cortex tweemaal zo hoog is als bij mensen zonder psychische afwijking. Dit gaat gepaard met een verhoogde expressie van het enzym DNA methyltransferase-1 mRNA. Dit kan methylatie van Cytosine veroorzaken met downregulering van de expressie van reeline tot gevolg.[70]
Een andere mogelijke oorzaak van de verminderde hoeveelheden reeline-mRNA en reeline bij schizofrenie is eveneens epigenetische hypermethylering maar dan van de reeline-gen promotor.[71] Deze bevindingen komen overeen met observaties uit de jaren '60, waaruit bleek dat het toedienen van methionine bij schizofreniepatiënten in 60 tot 70 % van de gevallen leidde tot een ernstige verergering van de symptomen van deze aandoening.[72][73][74][75] Methyleringremmers en remmers van histone deacetylase (zoals valproïnezuur) verhogen de hoeveelheid reeline-mRNA.[76][77][78]
Behandeling met L-methionine bij muizen leidde tot een downregulatie van de fenotypische expressie van reeline.[79]
Dit alles lijkt de epigenetische hypothese met betrekking tot de rol van reeline in schizofrenie te bevestigen.[80]
Genetische oorzaken
Het chromosoomgebied 7q22 is de locatie van het reeline-gen. Dit gebied wordt daarnaast verondersteld een rol te spelen bij schizofrenie.[81] Het gen zelf is met schizofrenie in verband gebracht in een uitgebreide studie, waarin bleek dat het polymorfisme rs7341475 het risico op schizofrenie wel bij vrouwen maar niet bij mannen verhoogde. Vrouwen met dit enkel-nucleotide polymorfisme lopen volgens deze studie 1,4x zoveel kans op schizofrenie.[82] Bij families waarin schizofrenie voorkomt zijn variaties in het RELN-allel in verband gebracht met het werkgeheugen.[81][83]
Een andere studie toont aan dat schizofreniepatiënten in de perifere lymfocyten een verminderde hoeveelheid VLDL-receptoren (VLDLR) hebben.[84] Na een half jaar durende behandeling met antipsychotica steeg de expressie.
Ook de interactie van reeline met bepaalde risicogenen speelt mogelijk een rol bij schizofrenie en andere psychische aandoeningen. Een voorbeeld is de neuronale transcriptiefactor NPAS3, waarvan de verstoring mogelijk de basis vormt voor schizofrenie en achterstanden in het leerproces.[85] Knockout-muizen die dit of het gelijksoortige eiwit NPAS1 missen hebben aanzienlijk minder reeline.[86] Een ander voorbeeld is het met schizofrenie verband houdende gen methylenetetrahydrofolate reductase waarvan het product de formatie van methione regelt. Muizen (en vermoedelijk mensen) met een tekort aan dit gen hebben een verminderde hoeveelheid reeline in het cerebellum.[87]
Bipolaire stoornis
Post-mortem onderzoek van menselijke hersenen heeft aangetoond dat een verminderde expressie van het reeline-gen in combinatie met upregulatie van het enzym DNMT1 kenmerkend is voor bipolaire stoornissen in combinatie met psychose.[88] Volgens een onderzoek uit 2006 is bij mensen met een bipolaire stoornis de hoeveelheid DNMT1 en bijgevolg ook de hoeveelheid reeline en GAD67 in de basale ganglia op normaal niveau, terwijl in de prefrontale cortex sprake is van dezelfde afwijkingen als bij schizofreniepatiënten.[89]
In 2009 kwamen aanwijzingen dat veranderingen van het RELN-gen (SNP rs362719) specifiek verband houden met bipolaire stoornis bij vrouwen.
Depressie
Een verminderde hippocampale plasticiteit werkt depressies in de hand en kan het gevolg zijn van een verminderde reeline-expressie. Dit zou tevens verband kunnen houden met de veronderstelde rol van corticosteroïden bij depressies.[90]
Autisme
Autisme is een pervasieve ontwikkelingsstoornis die zowel genetisch als door de omgeving kan worden veroorzaakt. Op genetisch vlak kan autisme gelinkt worden aan een aantal defecten aan chromosoom 7. Het reeline-gen bevindt zich eveneens op dit chromosoom. Over de rol van reeline bij autisme is echter nog weinig duidelijk. In de post-mortem onderzochte hersenen van mensen met autisme zijn verminderde hoeveelheden reeline aangetroffen. Onderzoek naar het veronderstelde verband tussen reeline en autisme heeft echter tot nu toe alleen tegenstrijdige resultaten opgeleverd.[91]
Temporalekwabepilepsie
Een verstoring van de neuronale migratie als gevolg van een verminderde expressie van reeline in het weefsel van de hippocampus lijkt bij een deel van de patiënten rechtstreeks verband te houden met de migratie van korrelcellen, en daarmee met epilepsie aan de temporale kwab. Verhoogde hypermethylering van de reeline-promotor speelt ook een rol.[92][93][94]
Uit ander onderzoek blijkt dat reeline bij ratten en andere knaagdieren de migratie van progenitorcellen van granulecellen (DGC) aanstuurt en zo de integratie van deze cellen in de gyrus dentatus regelt. Dit gebeurt zowel bij ongeboren als bij volwassen exemplaren. Dissociatie van de migrerende neuroblasten zonder reeline verloopt niet goed. DGC-cellen spelen op hun beurt een grote rol bij epileptische aanvallen.[95]
In een door middel van kaïnezuur opgewekt experimenteel epilepsiemodel bij muizen heeft toegediend reeline de voor temporalekwabepilepsie typische verspreiding van DGC-cellen als gevolg van een verstoorde migratie voorkomen.[96]
Ziekte van Alzheimer
Volgens een studie gaat de ziekte van Alzheimer gepaard met een veranderd patroon van zowel de reeline-expressie als de glycosylering. De in de cortex van onderzochte alzheimerpatiënten aangetroffen hoeveelheid reeline was 40% hoger dan gebruikelijk, terwijl de hoeveelheid eiwit in het cerebellum hetzelfde was als bij mensen zonder Alzheimer.[97] Dit komt overeen met een eerdere studie van het expressiepatroon bij dubbel-transgene muizen waarbij zowel APP als presinilines worden geëxprimeerd.[98] Het aantal Cajal-Retziuscellen in de eerste corticale laag dat reeline aanmaakt is daarentegen abnormaal laag bij Alzheimer-patiënten, waardoor de synaptogenese negatief wordt beïnvloed.[99][100]
Een uitgebreide studie uit 2008 toonde aan dat veranderingen in het RELN-gen bij vrouwen verband zou houden met een toegenomen kans op Alzheimer.[101] Reeline interageert met het amyloïde precursor eiwit, wat de ontwikkeling van neurieten stimuleert.[102] Ook gaat het mogelijk de beta- amyloïde geïnduceerde onderdrukking van de goede werking van NMDA-receptoren tegen.[103][104]
Kanker
Bij tumoren verandert vaak het patroon van de DNA-methylering. Hierdoor wordt ook het RELN-gen mogelijk beïnvloed. Volgens een studie wordt bij alvleesklierkanker de expressie van reeline onderdrukt, waardoor ook de pathway van het eiwit verstoord raakt. Bij kankercellen die het eiwit nog wel exprimeerden leidde het onderdrukken van deze expressie tot een toegenomen metastase.[105] Bij prostaatkanker blijkt de expressie van reeline daarentegen juist aan de hoge kant te zijn, en bovendien rechtstreeks samen te hangen met een hoge Gleasonscore, die duidt op een agressieve vorm van kanker.[106] Ook bij retinoblastoom is uit weefselstudie een verhoogde expressie van onder meer het reelinegen gebleken.[107]
Andere ziekten
Volgens een genoombrede associatie-studie met 550.0000 enkel-nucleotide polymorfismen speelt mutatie van het reeline-gen een rol bij otosclerose.[108]
Nieuw onderzoek bij muizen heeft uitgewezen dat een verhoogde expressie van zowel DAB1 als RELN mogelijk een rol speelt bij het beschermen tegen cerebrale malaria. Bij muizen die weerstand bieden tegen malaria remt de activering van het RELN vermoedelijk de beschadiging van zenuwcellen en de Tau-fosforylering.[109]
Reeline en psychofarmaca
Uit post-mortem onderzoeken is gebleken dat reeline bij een groot aantal afwijkingen aan de hersenen is betrokken, waarmee het mogelijk een rol heeft als psychofarmaceutisch geneesmiddel.
Van valproïnezuur, dat een inhibitor is van histone deacetylase, wordt gedacht dat het een positieve werking heeft wanneer het wordt ingenomen in combinatie met antipsychotica. Uit een experiment van Fatemi et al., waarbij gedurende 21 dagen van peritoneale injecties de hoeveelheid RELN mRNA en reeline in de prefrontale cortex van ratten werd gemeten, bleek anderzijds geen verhoogde reeline-expressie als gevolg van valproïnezuur.[110] De resultaten van het betreffende experiment waren als volgt:
| Reeline-expressie | Clozapine | Fluoxetine | Haloperidol | Lithium | Olanzapine | Valproïnezuur |
|---|---|---|---|---|---|---|
| proteïne | ↓ | ↔ | ↓ | ↓ | ↑ | ↔ |
| mRNA | ↑ | ↑ | ↓ | ↑ | ↑ | ↓ |
In een nieuwe studie van Fatemi et al. werd behalve de corticale expressie van reeline ook die van VLDLR, DAB1, GSK3beta, GAD65 en GAD67 gemeten.[111]
Literatuur
- Het boek: Fatemi, S. Hossein, Reelin Glycoprotein: Structure, Biology and Roles in Health and Disease. Springer, Berlin (2008), p. 444 pages
- Een recensie: Förster E, Jossin Y, Zhao S, Chai X, Frotscher M, Goffinet AM (februari 2006). Recent progress in understanding the role of Reelin in radial neuronal migration, with specific emphasis on the dentate gyrus. Eur. J. Neurosci. 23 (4): 901–9. DOI:10.1111/j.1460-9568.2006.04612.x.
Externe links
Artikels, publicaties, websites
- Gabriella D'Arcangelo. Rutgers University Geraadpleegd op 2008-08-23
- www.wikigenes.org
Figuren en afbeeldingen
- Expressie van het reelinegen bij muizen. St. Jude Children’s Research Hospital Geraadpleegd op 2008-08-23
- Schematische weergave van de signalen via de receptoren apoER2 en VLDL Geraadpleegd op 2008-08-23 – Een afbeelding van Beffert U, Stolt PC, Herz J (maart 2004). Functions of lipoprotein receptors in neurons. J. Lipid Res. 45 (3): 403–9. DOI:10.1194/jlr.R300017-JLR200.
- Voorgesteld mechanisme dat de afscheiding van reelin bij muizen reguleert. Proc. Natl. Acad. Sci. USA Geraadpleegd op 2008-08-23 – A figure from Dong E, Agis-Balboa RC, Simonini MV, Grayson DR, Costa E, Guidotti A (augustus 2005). Reelin and glutamic acid decarboxylase67 promoter remodeling in an epigenetic methionine-induced mouse model of schizophrenia. Proc. Natl. Acad. Sci. U.S.A. 102 (35): 12578–83. DOI:10.1073/pnas.0505394102.
- Corticogenesis bij muizen Geraadpleegd op 2008-08-23 – A figure from Magdaleno SM, Curran T (december 2001). Brain development: integrins and the Reelin pathway. Curr. Biol. 11 (24): R1032–5. DOI:10.1016/S0960-9822(01)00618-2.
- Effecten van natuurlijke en kunstmatige RELN-mutaties op het voorspelde eiwit.. Nature Genetics Geraadpleegd op 2008-08-23 Een afbeelding van Hong SE, Shugart YY, Huang DT, et al. (september 2000). Autosomal recessive lissencephaly with cerebellar hypoplasia is associated with human RELN mutations. Nat. Genet. 26 (1): 93–6. DOI:10.1038/79246.
- MRI-analyse. Nature Genetics Geraadpleegd op 2008-08-23 – Een afbeelding van Hong et al.
Bronnen, noten en/of referenties
|

